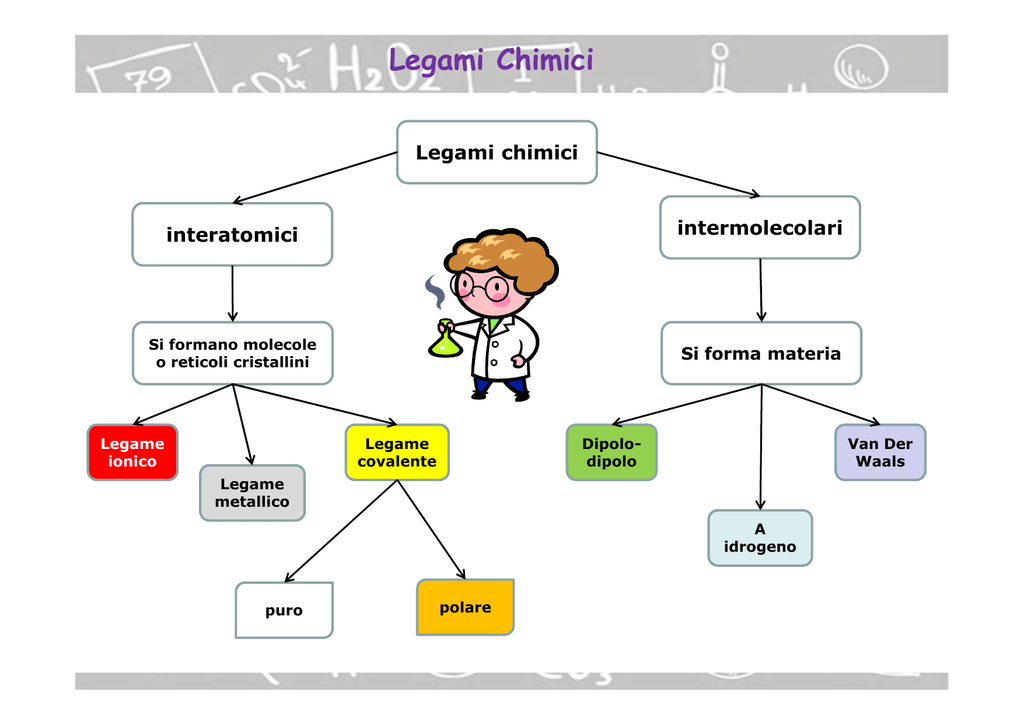
Legami Chimici Spiegati Ai Bambini

Ciao bambini! Oggi vi racconterò una storia super affascinante, una storia che si svolge nel mondo piccolissimo degli atomi! Preparatevi, perché stiamo per scoprire i segreti dei legami chimici, proprio come fanno gli scienziati più esperti!
Immaginatevi che il mondo sia fatto di tantissimi mattoncini LEGO® minuscoli, invisibili ad occhio nudo. Questi mattoncini sono gli atomi. Ogni atomo è come un piccolo personaggio con una personalità propria, e alcuni di questi personaggi amano stare vicini ad altri, proprio come voi amate stare con i vostri amici!
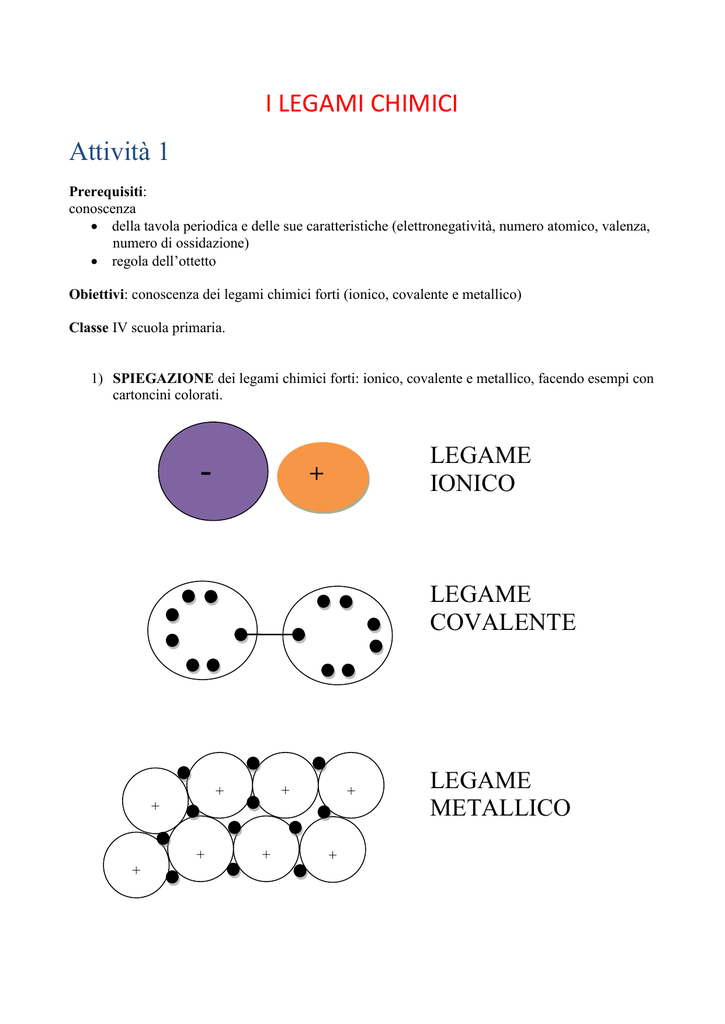
Questi atomi, per stare vicini e formare qualcosa di più grande, si tengono per mano in un modo speciale. Questo "tenersi per mano" si chiama legame chimico. I legami chimici sono come delle calamite invisibili che tengono insieme gli atomi, formando delle molecole.
Il Ballo degli Elettroni: Legame Covalente
Ora, entriamo ancora più nel dettaglio. Immaginate che gli atomi siano ballerini. Alcuni ballerini (gli atomi) sono un po' timidi e non vogliono ballare da soli. Allora, cosa fanno? Si mettono insieme e ballano condividendo la loro musica! La musica, in questo caso, sono gli elettroni.
Il legame covalente è proprio questo: gli atomi condividono i loro elettroni per diventare più felici e stabili. È come avere un giocattolo preferito e dividerlo con il tuo migliore amico: entrambi siete contenti!
Un esempio perfetto di legame covalente è l'acqua, quella che beviamo tutti i giorni! La molecola dell'acqua è formata da due atomi di idrogeno (H) e un atomo di ossigeno (O). L'ossigeno e gli idrogeni condividono i loro elettroni, formando un legame forte e stabile. È per questo che l'acqua è così importante per la vita! Senza questa condivisione di elettroni, non avremmo l'acqua che conosciamo.
E non finisce qui! Anche la plastica, quella con cui sono fatti molti dei vostri giocattoli, è tenuta insieme da legami covalenti. Tanti atomi di carbonio si legano tra loro condividendo i loro elettroni, creando lunghe catene che formano la plastica. Quindi, la prossima volta che prendete in mano un giocattolo di plastica, pensate a tutti quegli atomi che stanno ballando insieme grazie ai legami covalenti!
Esistono diversi tipi di legami covalenti. Alcuni sono come una stretta di mano decisa, dove gli atomi condividono molti elettroni, rendendo il legame molto forte. Altri sono come un semplice saluto, dove la condivisione è meno intensa e il legame è più debole. Ma tutti sono importanti per formare le diverse sostanze che ci circondano.
Un'altra cosa importante da sapere è che i legami covalenti possono formare molecole di forme diverse. Possono essere lineari, come un filo, o a forma di anello, come una ciambella, o anche tridimensionali, come un pallone! La forma della molecola influenza le sue proprietà, ovvero come si comporta e come interagisce con altre molecole.
Ad esempio, il diamante, la pietra preziosa più dura che conosciamo, è formato da atomi di carbonio legati tra loro con legami covalenti molto forti in una struttura tridimensionale molto rigida. Questa struttura è ciò che rende il diamante così resistente.
Il Furto di Elettroni: Legame Ionico
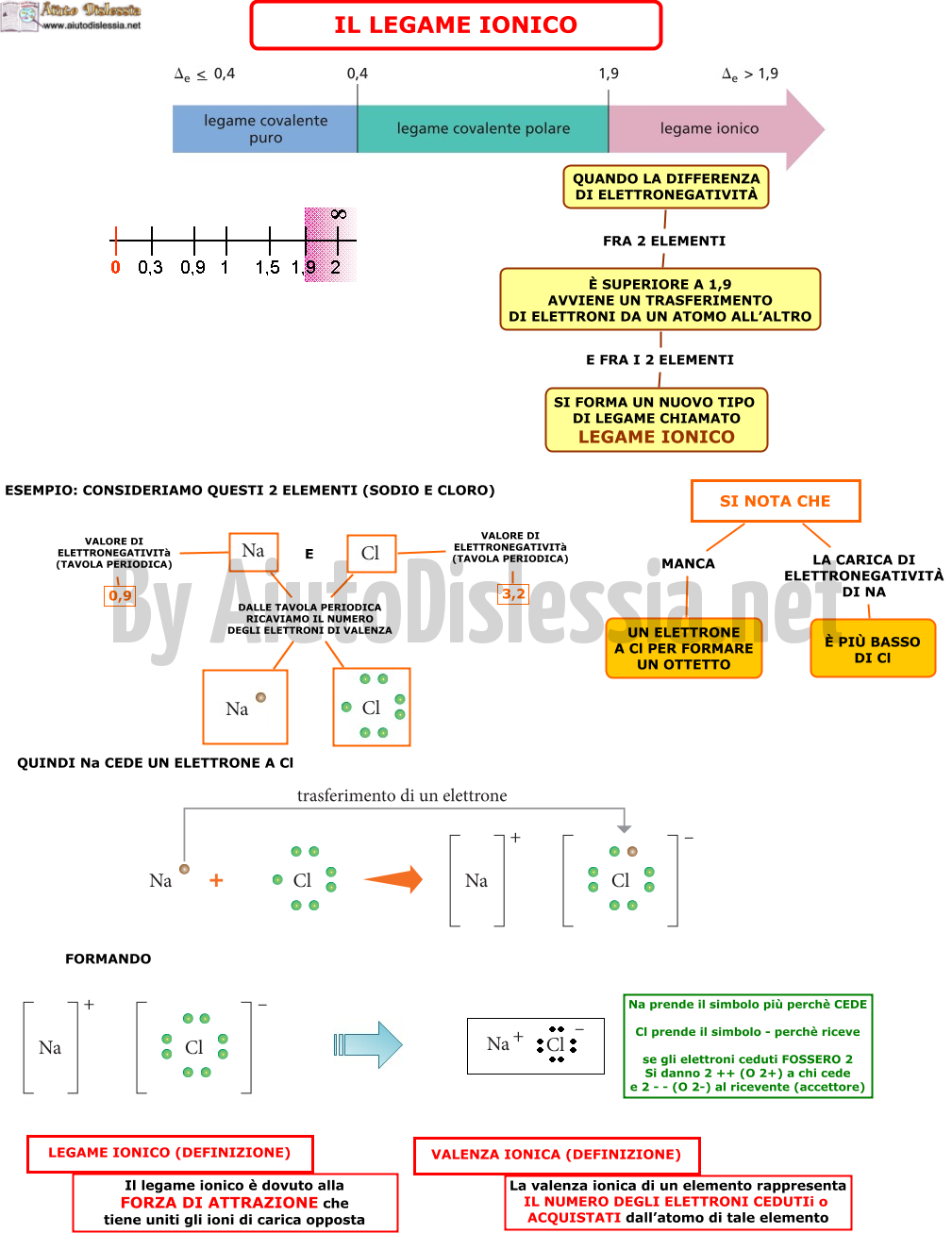
Ma non tutti gli atomi sono così gentili da condividere i loro elettroni. Alcuni atomi sono come dei piccoli bulli che vogliono rubare gli elettroni agli altri! Questo è quello che succede nel legame ionico.
Immaginate un atomo molto forte, come il cloro (Cl), e un atomo più debole, come il sodio (Na). Il cloro ha un grande desiderio di avere più elettroni, quindi "ruba" un elettrone al sodio.
Quando il sodio perde un elettrone, diventa positivo, proprio come quando fate qualcosa di buono e vi sentite pieni di energia positiva! Invece, quando il cloro guadagna un elettrone, diventa negativo, un po' come quando ricevete un regalo inaspettato.
Ora, questi due atomi, uno positivo (sodio) e uno negativo (cloro), si attraggono come due calamite con poli opposti! Questa attrazione è il legame ionico.
Il sale da cucina, quello che usiamo per dare sapore ai nostri piatti, è un esempio perfetto di legame ionico. È formato da atomi di sodio e cloro che si sono "rubati" gli elettroni a vicenda e si sono uniti per formare il cloruro di sodio (NaCl).
A differenza dei legami covalenti, dove gli atomi condividono gli elettroni, nei legami ionici gli elettroni vengono completamente trasferiti da un atomo all'altro. Questo crea ioni, ovvero atomi con una carica elettrica, che si attraggono l'un l'altro.
I composti ionici, come il sale, tendono a formare cristalli, ovvero strutture ordinate dove gli ioni positivi e negativi si alternano. Questi cristalli sono molto resistenti, ed è per questo che il sale è solido a temperatura ambiente.
Un'altra caratteristica interessante dei composti ionici è che si sciolgono facilmente in acqua. Quando mettiamo il sale nell'acqua, gli ioni sodio e cloro si separano e si disperdono nell'acqua. Questo perché l'acqua è una molecola polare, ovvero ha una carica positiva da una parte e una carica negativa dall'altra, e riesce ad attrarre gli ioni positivi e negativi, separandoli.
E i Legami Metallici?
Esistono anche i legami metallici, che sono diversi dai legami covalenti e ionici. Immaginate un gruppo di atomi di metallo, come il ferro o il rame, che si tengono tutti insieme. Questi atomi di metallo sono come una squadra di calciatori: condividono i loro elettroni in modo molto speciale.
Invece di condividere gli elettroni solo con un atomo vicino, come fanno nei legami covalenti, gli atomi di metallo condividono i loro elettroni con tutti gli atomi del metallo! È come se avessero creato un "mare" di elettroni che circonda tutti gli atomi.
Questo "mare" di elettroni è ciò che rende i metalli così speciali. Gli elettroni possono muoversi liberamente attraverso il metallo, trasportando l'energia elettrica e il calore molto facilmente. È per questo che i fili elettrici sono fatti di rame e le pentole sono fatte di metallo.
I legami metallici sono anche responsabili della lucentezza dei metalli. Quando la luce colpisce un metallo, gli elettroni nel "mare" assorbono l'energia della luce e la riemettono, creando quella brillantezza che tanto ammiriamo.
Inoltre, i legami metallici rendono i metalli malleabili e duttili. Malleabile significa che possiamo schiacciare un metallo senza romperlo, come fare una lamina di alluminio. Duttile significa che possiamo tirare un metallo per farne un filo, come fare un filo di rame. Questo perché gli atomi di metallo possono scorrere l'uno sull'altro senza rompere il legame, grazie al "mare" di elettroni che li tiene uniti.
Spero che questa storia dei legami chimici vi sia piaciuta! Ricordatevi che il mondo è pieno di atomi che si legano tra loro in modi diversi, creando tutte le sostanze che ci circondano. La scienza è un'avventura meravigliosa, e ci sono ancora tantissime cose da scoprire! Continuate a essere curiosi e a fare domande, perché la conoscenza è il tesoro più grande che possiamo avere!





Potresti essere interessato a
- Così Gesù Apparve Agli Apostoli Dopo La Morte
- Legno Di Ulivo Per Cani Fa Male
- Frase Del Giorno 4 Gennaio 2025
- 4 Immagini E 1 Parola Soluzioni 8 Lettere
- Documenti Per Gratuito Patrocinio 2023
- Preghiere Alla Divina Misericordia Di Giovanni Paolo Ii
- Letto Bambina Una Piazza E Mezza
- Nostra Signora Del Santissimo Sacramento
- Portate I Pesi Gli Uni Degli Altri
- La Mamma è Come Un Albero Grande
