Un Metallo Si Differenzia Da Un Non Metallo Perché

La chimica, la scienza che studia la materia e le sue proprietà, classifica gli elementi in vari modi, uno dei più fondamentali è la distinzione tra metalli e non metalli. Questa distinzione non è arbitraria, ma si basa su una serie di proprietà fisiche e chimiche ben definite. Comprendere queste differenze è cruciale per capire come gli elementi interagiscono tra loro, formando composti e determinando le proprietà dei materiali che ci circondano. Questa trattazione mira ad esplorare le differenze chiave tra metalli e non metalli, offrendo una panoramica completa e accessibile.
Caratteristiche Fisiche Distintive
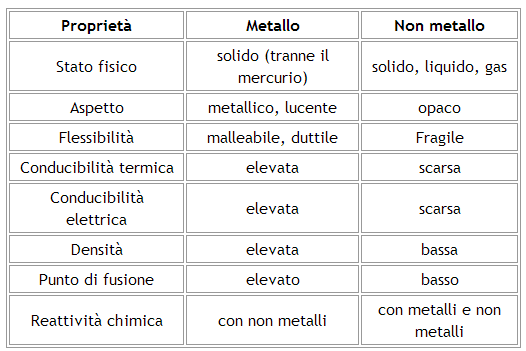
I metalli e i non metalli presentano differenze evidenti a livello di proprietà fisiche. Queste differenze influenzano il loro utilizzo in diverse applicazioni.
Conduttività Elettrica e Termica
Una delle proprietà più distintive dei metalli è la loro elevata conduttività elettrica e termica. Questo significa che i metalli permettono il flusso di elettroni (e quindi di corrente elettrica) e di calore attraverso la loro struttura con grande facilità. Questo è dovuto alla presenza di elettroni liberi, o delocalizzati, che si muovono facilmente attraverso il reticolo metallico. L'oro (Au), l'argento (Ag) e il rame (Cu) sono esempi eccellenti di metalli altamente conduttivi, ampiamente utilizzati nell'elettronica e nei cablaggi. Al contrario, i non metalli sono generalmente scarsi conduttori di elettricità e calore. Il diamante (una forma allotropica del carbonio) fa eccezione per la conduttività termica, ma rimane un isolante elettrico.
Lucentezza Metallica
I metalli, quando lucidati, presentano una caratteristica lucentezza metallica, un aspetto brillante e riflettente. Questa proprietà è dovuta all'interazione degli elettroni liberi con la luce. Gli elettroni assorbono e riemettono la luce a diverse lunghezze d'onda, conferendo al metallo il suo aspetto lucido. I non metalli, al contrario, sono generalmente opachi e non riflettono la luce in modo simile. Ad esempio, il ferro (Fe) appena lucidato ha un'evidente lucentezza metallica, mentre lo zolfo (S) è opaco e giallo.
Malleabilità e Duttilità
I metalli sono generalmente malleabili, cioè possono essere ridotti in lamine sottili senza rompersi (come nel caso dell'alluminio utilizzato per la carta stagnola), e duttili, cioè possono essere trafilati in fili (come il rame utilizzato nei cavi elettrici). Questa proprietà è dovuta alla capacità degli atomi metallici di scivolare l'uno sull'altro all'interno del reticolo cristallino. I non metalli sono tipicamente fragili e non malleabili né duttili. Se si tenta di piegare un pezzo di zolfo o di carbonio (grafite), questo si romperà facilmente invece di deformarsi.
Stato Fisico a Temperatura Ambiente
A temperatura ambiente (circa 25°C), la maggior parte dei metalli sono solidi, con l'eccezione del mercurio (Hg), che è liquido. I non metalli possono esistere nei tre stati fisici a temperatura ambiente: solidi (come il carbonio e lo zolfo), liquidi (come il bromo) e gassosi (come l'ossigeno e l'azoto).
Densità
I metalli tendono ad avere densità più elevate rispetto ai non metalli. Questo significa che a parità di volume, un metallo pesa di più di un non metallo. Ad esempio, il piombo (Pb) è un metallo estremamente denso, mentre l'ossigeno (O₂) è un gas a bassa densità. Tuttavia, ci sono eccezioni a questa regola.
Comportamento Chimico Differenziato
Le differenze tra metalli e non metalli non si limitano alle proprietà fisiche, ma si estendono anche al loro comportamento chimico, in particolare alla loro tendenza a formare ioni e legami chimici.
Formazione di Ioni
I metalli tendono a perdere elettroni durante le reazioni chimiche, formando ioni positivi, chiamati cationi. Ad esempio, il sodio (Na) perde facilmente un elettrone per formare lo ione Na⁺. Questa tendenza è dovuta alla bassa energia di ionizzazione dei metalli. I non metalli, al contrario, tendono ad acquistare elettroni durante le reazioni chimiche, formando ioni negativi, chiamati anioni. Ad esempio, il cloro (Cl) acquista facilmente un elettrone per formare lo ione Cl⁻. Questa tendenza è dovuta all'elevata affinità elettronica dei non metalli.
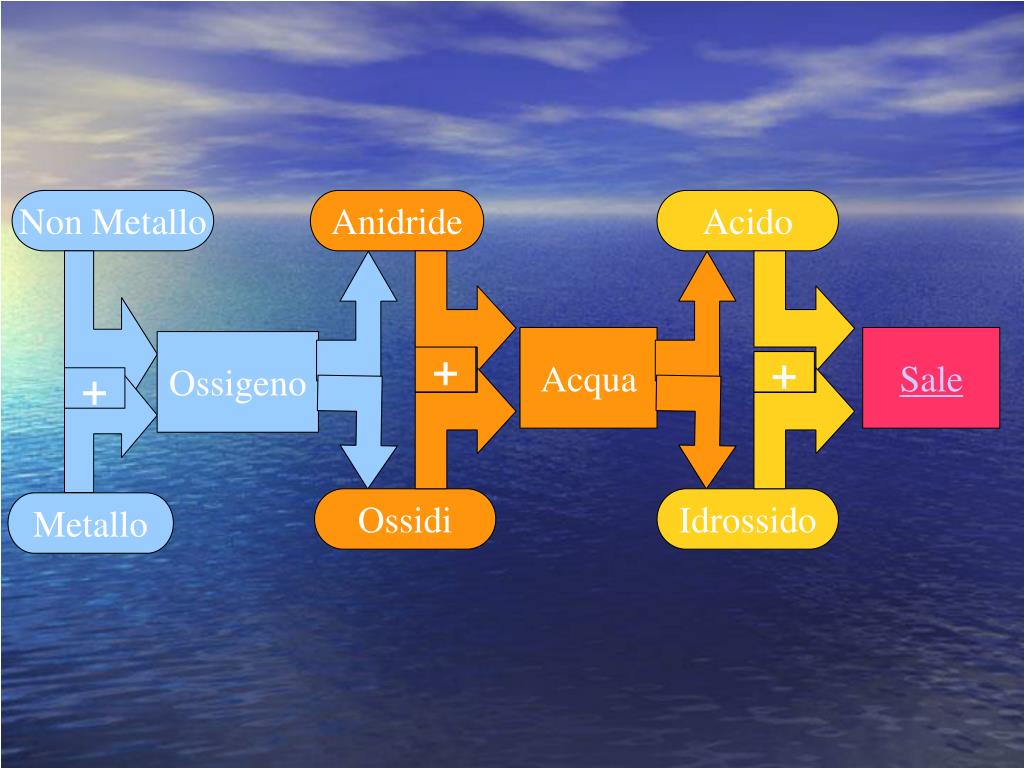
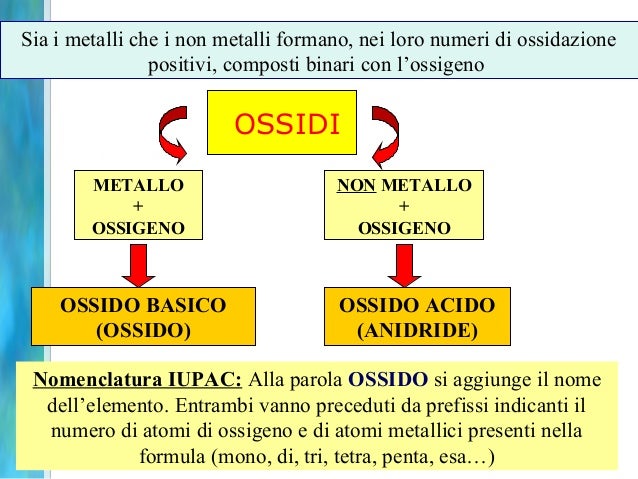
Formazione di Ossidi
I metalli reagiscono con l'ossigeno per formare ossidi basici. Quando questi ossidi si dissolvono in acqua, formano soluzioni basiche (con un pH superiore a 7). Ad esempio, l'ossido di sodio (Na₂O) reagisce con l'acqua per formare idrossido di sodio (NaOH), una base forte. I non metalli reagiscono con l'ossigeno per formare ossidi acidi. Quando questi ossidi si dissolvono in acqua, formano soluzioni acide (con un pH inferiore a 7). Ad esempio, l'anidride carbonica (CO₂) reagisce con l'acqua per formare acido carbonico (H₂CO₃), un acido debole.
Reazioni con gli Acidi
Molti metalli reagiscono con gli acidi diluiti per formare idrogeno gassoso e un sale. Ad esempio, lo zinco (Zn) reagisce con l'acido cloridrico (HCl) per formare cloruro di zinco (ZnCl₂) e idrogeno gassoso (H₂). I non metalli generalmente non reagiscono con gli acidi diluiti in questo modo. Questo comportamento è legato al potenziale di riduzione dei metalli.
Elettronegatività
L'elettronegatività è una misura della capacità di un atomo di attrarre elettroni in un legame chimico. I metalli hanno generalmente bassa elettronegatività, mentre i non metalli hanno alta elettronegatività. Questa differenza nell'elettronegatività influenza il tipo di legame chimico che si forma tra gli atomi. I metalli tendono a formare legami ionici con i non metalli, mentre i non metalli tendono a formare legami covalenti tra loro.
Struttura Elettronica e Proprietà
Le differenze nelle proprietà fisiche e chimiche tra metalli e non metalli sono radicate nella loro struttura elettronica, in particolare nella disposizione degli elettroni di valenza (gli elettroni nel guscio più esterno dell'atomo).
I metalli hanno generalmente pochi elettroni di valenza (solitamente 1, 2 o 3) e tendono a perdere facilmente questi elettroni per raggiungere una configurazione elettronica stabile, simile a quella del gas nobile più vicino. Questo porta alla formazione di cationi e alla buona conduttività elettrica e termica. La presenza di una "mare" di elettroni delocalizzati è essenziale per le proprietà metalliche.
I non metalli hanno generalmente molti elettroni di valenza (solitamente 5, 6 o 7) e tendono ad acquisire elettroni per raggiungere una configurazione elettronica stabile. Questo porta alla formazione di anioni e alla loro tendenza a formare legami covalenti con altri non metalli.
Esempi e Applicazioni
Le proprietà uniche di metalli e non metalli li rendono adatti a una vasta gamma di applicazioni.
- Metalli: Il ferro è utilizzato nella costruzione di ponti, edifici e automobili per la sua resistenza. Il rame è utilizzato nei cavi elettrici per la sua elevata conduttività. L'alluminio è utilizzato nella produzione di aerei e lattine per la sua leggerezza e resistenza alla corrosione. Il titanio è utilizzato in impianti medici per la sua biocompatibilità.
- Non metalli: L'ossigeno è essenziale per la respirazione e la combustione. Il carbonio è la base della chimica organica e forma la spina dorsale di tutte le molecole biologiche. Il silicio è utilizzato nella produzione di semiconduttori per l'elettronica. Lo zolfo è utilizzato nella produzione di acido solforico, un importante prodotto chimico industriale.
Conclusioni
In sintesi, la distinzione tra metalli e non metalli si basa su una serie di proprietà fisiche e chimiche interconnesse, che a loro volta sono determinate dalla loro struttura elettronica. I metalli sono generalmente buoni conduttori di elettricità e calore, malleabili, duttili e lucenti, tendono a perdere elettroni e formare ossidi basici. I non metalli sono generalmente scarsi conduttori, fragili e opachi, tendono ad acquisire elettroni e formare ossidi acidi. Comprendere queste differenze è fondamentale per la chimica e per la scienza dei materiali, e ci permette di progettare e utilizzare materiali con proprietà specifiche per una vasta gamma di applicazioni. Un'ulteriore area di studio interessante sono i metalloidi o semimetalli, che possiedono proprietà intermedie tra metalli e non metalli e trovano applicazione cruciale nell'elettronica.
Invito ad approfondire ulteriormente lo studio degli elementi chimici e delle loro proprietà, esplorando le tavole periodiche interattive e consultando risorse didattiche online. La chimica è ovunque intorno a noi, e comprenderla ci permette di apprezzare il mondo che ci circonda con occhi diversi.