Tavola Periodica Degli Elementi In Italiano
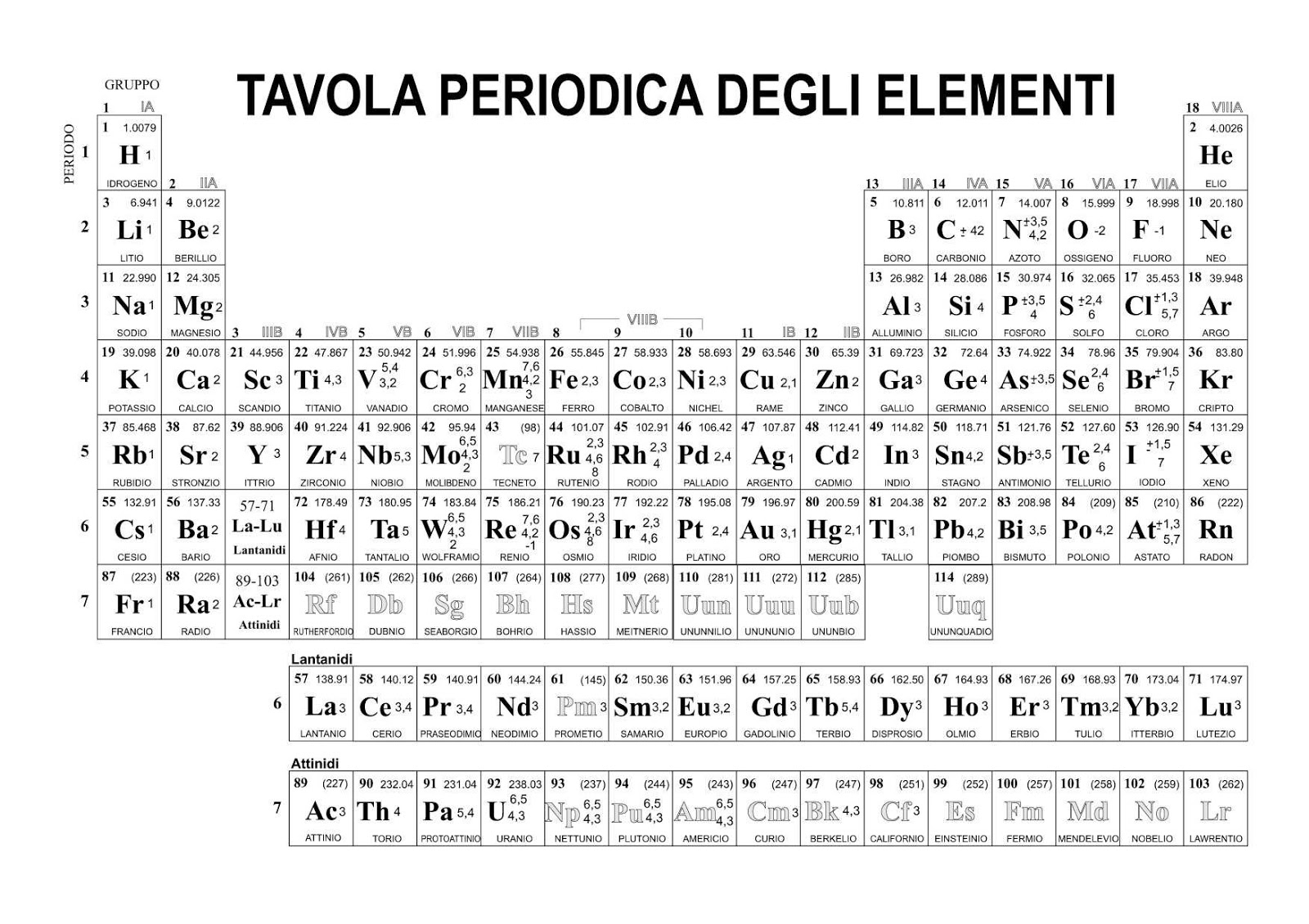
La Tavola Periodica degli Elementi, conosciuta anche come Tabella di Mendeleev, è una rappresentazione tabellare degli elementi chimici ordinati in base al loro numero atomico (numero di protoni), configurazione elettronica e proprietà chimiche ricorrenti. È un pilastro fondamentale della chimica e fornisce un quadro organizzato e predittivo del comportamento degli elementi.
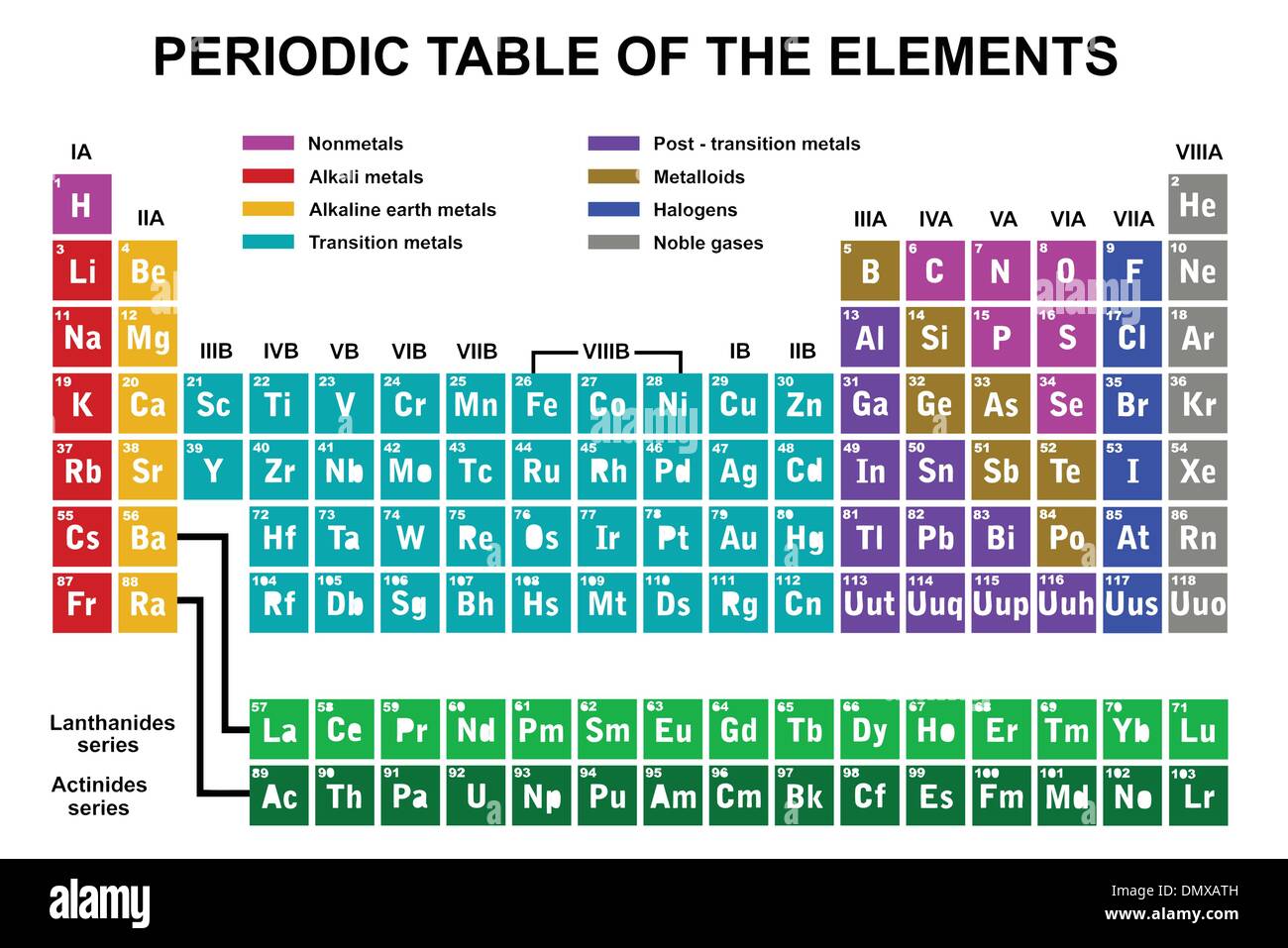
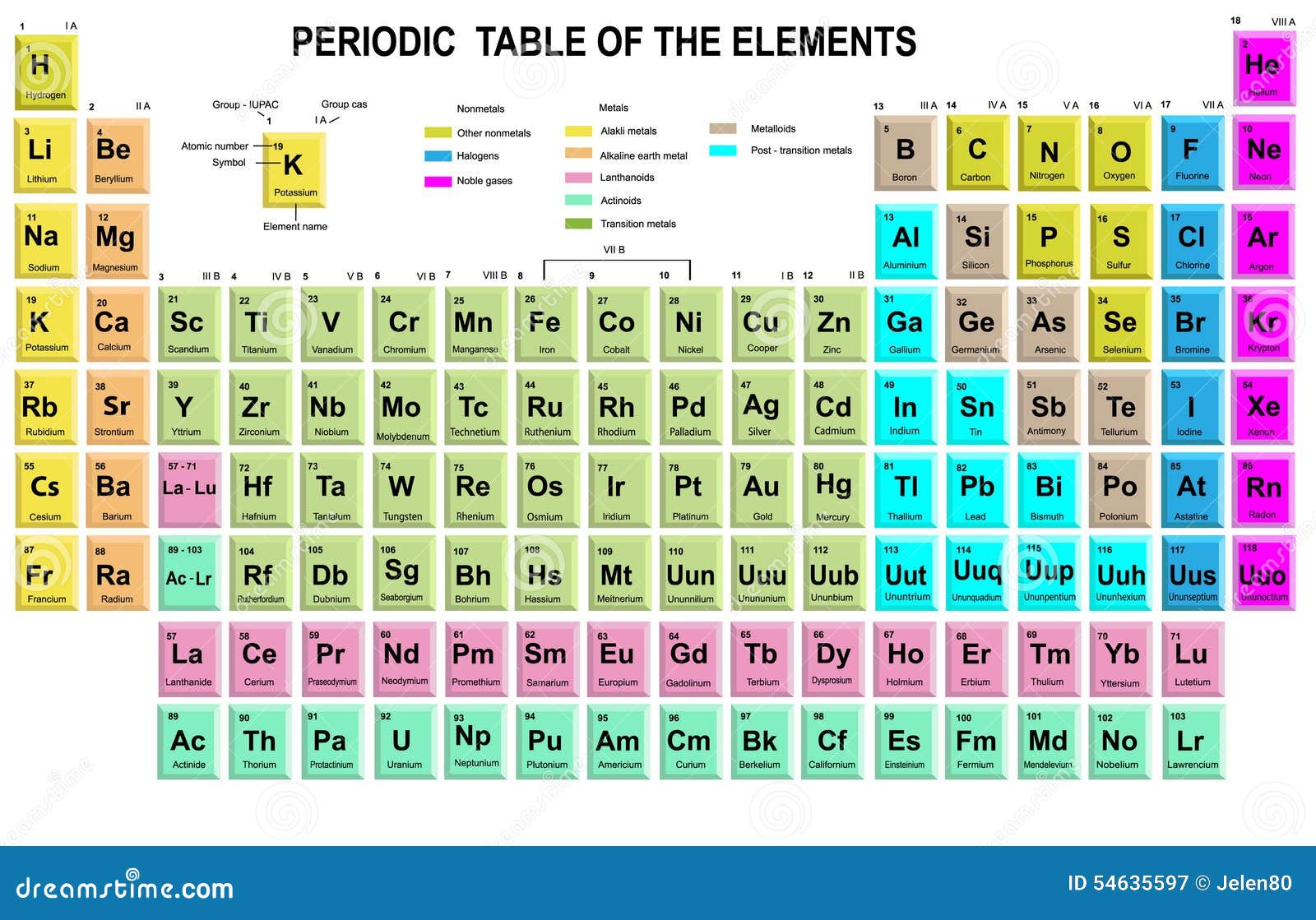
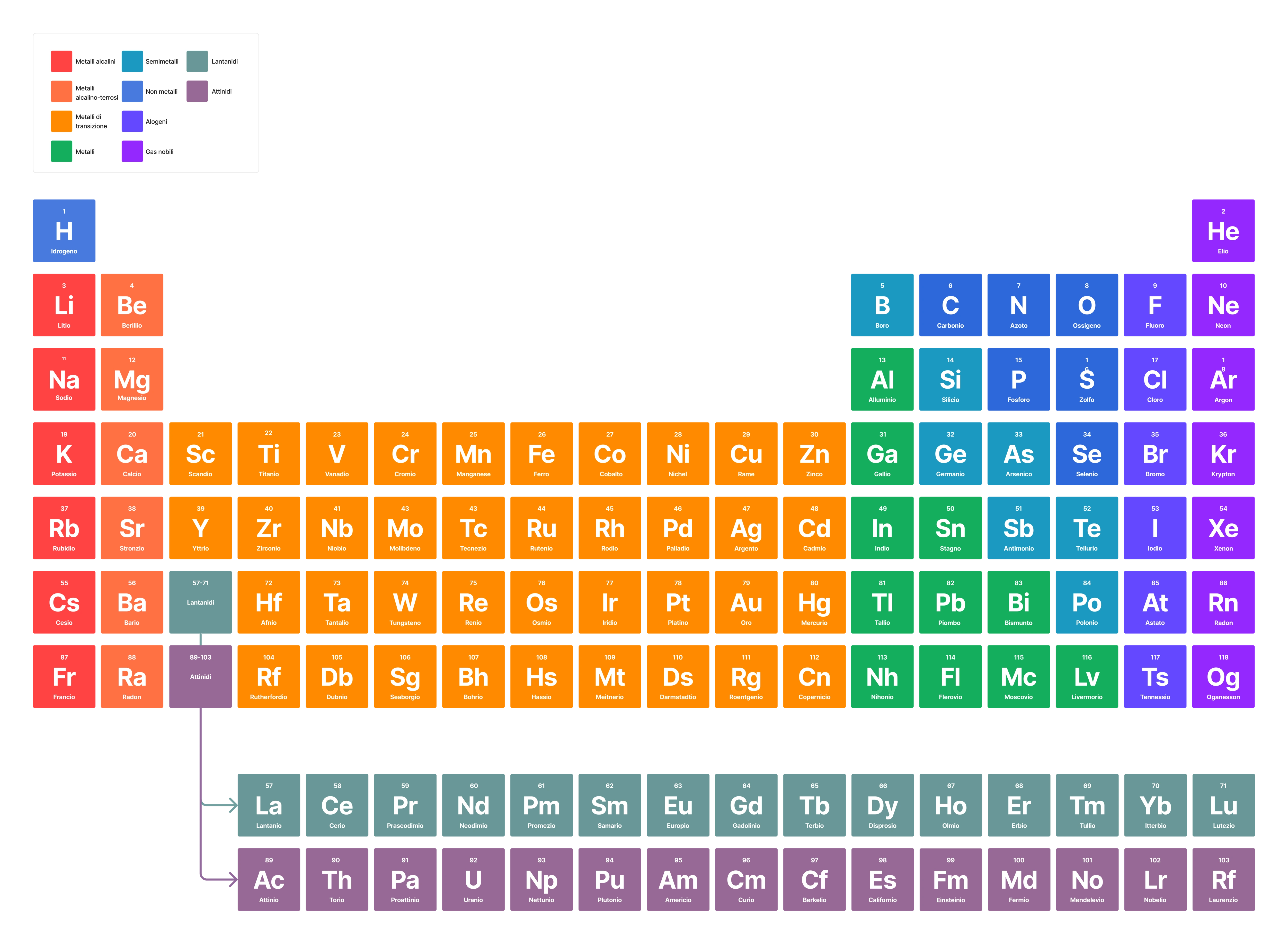
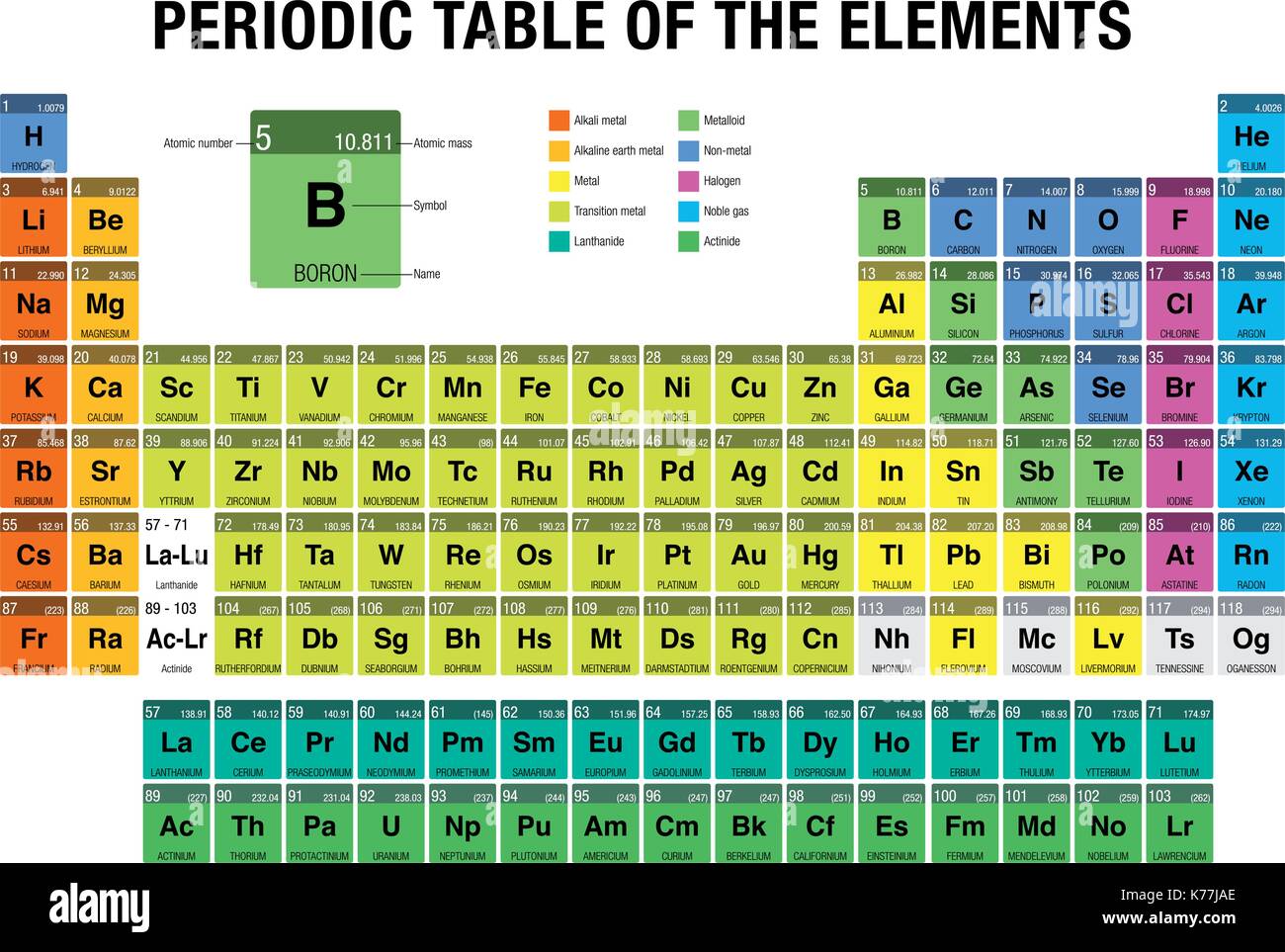
Organizzazione e Struttura della Tavola Periodica
La tavola periodica è organizzata in righe (orizzontali) chiamate periodi e colonne (verticali) chiamate gruppi o famiglie. Ogni casella della tabella contiene informazioni su un elemento, inclusi il suo simbolo chimico, il numero atomico e la massa atomica.
Periodi
I periodi rappresentano il livello di energia più alto occupato dagli elettroni in un atomo di quell'elemento. Gli elementi all'interno di un periodo hanno numeri atomici consecutivi e mostrano una graduale variazione nelle proprietà chimiche da sinistra a destra. Ci sono sette periodi numerati da 1 a 7. Il primo periodo contiene solo idrogeno (H) ed elio (He), mentre i periodi successivi diventano progressivamente più lunghi.
Gruppi (o Famiglie)
I gruppi sono le colonne verticali della tavola periodica. Gli elementi all'interno dello stesso gruppo hanno lo stesso numero di elettroni di valenza (elettroni nel guscio più esterno), che determina in gran parte le loro proprietà chimiche simili. Tradizionalmente, i gruppi erano numerati da 1 a 18 (o usando la notazione con lettere A e B), ma la nomenclatura IUPAC (International Union of Pure and Applied Chemistry) raccomanda la numerazione da 1 a 18.
Alcuni gruppi hanno nomi comuni:
- Gruppo 1: Metalli alcalini (escluso l'idrogeno) – Reattivi, formano ioni +1
- Gruppo 2: Metalli alcalino-terrosi – Reattivi, formano ioni +2
- Gruppo 16: Calcogeni
- Gruppo 17: Alogeni – Molto reattivi, formano ioni -1
- Gruppo 18: Gas nobili – Inerti (poco reattivi) a causa della loro configurazione elettronica stabile
Blocchi
La tavola periodica può anche essere divisa in blocchi, in base al tipo di orbitale atomico (s, p, d, f) che viene riempito con l'ultimo elettrone. Questo raggruppamento riflette le proprietà chimiche e fisiche degli elementi.
- Blocco s: Gruppi 1 e 2 (e l'elio)
- Blocco p: Gruppi 13-18
- Blocco d: Gruppi 3-12 (metalli di transizione)
- Blocco f: Lantanidi e attinidi (elementi di transizione interna)
Tendenze Periodiche
Le proprietà degli elementi mostrano tendenze prevedibili all'interno della tavola periodica. Queste tendenze sono dovute alle variazioni della carica nucleare efficace e alla distanza degli elettroni dal nucleo.
Raggio Atomico
Il raggio atomico, una misura della dimensione di un atomo, generalmente diminuisce da sinistra a destra attraverso un periodo (a causa dell'aumento della carica nucleare efficace) e aumenta dall'alto verso il basso in un gruppo (a causa dell'aggiunta di gusci elettronici).
Esempio: Nel periodo 3, il raggio atomico diminuisce da Na a Cl.
Energia di Ionizzazione
L'energia di ionizzazione è l'energia necessaria per rimuovere un elettrone da un atomo in fase gassosa. L'energia di ionizzazione generalmente aumenta da sinistra a destra attraverso un periodo (a causa dell'aumento della carica nucleare efficace) e diminuisce dall'alto verso il basso in un gruppo (a causa della maggiore distanza degli elettroni di valenza dal nucleo).
Esempio: L'energia di ionizzazione è maggiore per il fluoro (F) rispetto al litio (Li).
Elettronegatività
L'elettronegatività è la misura della capacità di un atomo di attrarre elettroni in un legame chimico. L'elettronegatività generalmente aumenta da sinistra a destra attraverso un periodo (a causa dell'aumento della carica nucleare efficace) e diminuisce dall'alto verso il basso in un gruppo (a causa della maggiore distanza degli elettroni di valenza dal nucleo).
Esempio: L'ossigeno (O) è più elettronegativo del sodio (Na).
Carattere Metallico
Il carattere metallico si riferisce alla tendenza di un elemento a comportarsi come un metallo (ad esempio, perdere facilmente elettroni, formare cationi positivi, condurre elettricità). Il carattere metallico generalmente diminuisce da sinistra a destra attraverso un periodo e aumenta dall'alto verso il basso in un gruppo. Gli elementi nella parte sinistra e inferiore della tavola periodica sono più metallici, mentre quelli nella parte destra e superiore sono meno metallici (più non metallici).
Esempio: Il cesio (Cs) è uno dei metalli più reattivi.
Applicazioni Pratiche e Importanza
La tavola periodica non è solo un diagramma; è uno strumento potente per la comprensione e la predizione del comportamento chimico. È utilizzata in numerosi campi:
- Chimica: Prevedere reazioni chimiche, comprendere legami chimici, progettare nuovi materiali.
- Fisica: Studiare le proprietà degli elementi e dei loro isotopi.
- Biologia: Comprendere il ruolo degli elementi essenziali negli organismi viventi.
- Scienza dei Materiali: Progettare materiali con proprietà specifiche (resistenza, conduttività, ecc.).
- Medicina: Sviluppare farmaci e trattamenti medici.
- Ingegneria: Selezionare i materiali appropriati per varie applicazioni.
Esempio concreto: Lo sviluppo di batterie agli ioni di litio ha rivoluzionato l'elettronica portatile. La comprensione delle proprietà del litio e di altri elementi nella tavola periodica è stata fondamentale per questa innovazione.
Esempio concreto: La sintesi dell'ammoniaca (NH3) tramite il processo Haber-Bosch, che utilizza il ferro come catalizzatore, ha trasformato l'agricoltura. La tavola periodica ha aiutato a identificare il ferro come catalizzatore efficace.
Limitazioni e Considerazioni
Sebbene la tavola periodica sia estremamente utile, presenta alcune limitazioni:
- Non predice con precisione tutte le proprietà: Alcune proprietà, come il punto di fusione, sono più difficili da prevedere con precisione.
- Comportamento anomalo di alcuni elementi: Alcuni elementi, come l'idrogeno, non si adattano perfettamente a un singolo gruppo.
- Isotopi: La tavola periodica non tiene conto degli isotopi, che sono atomi dello stesso elemento con un numero diverso di neutroni.
La Scoperta di Nuovi Elementi
La tavola periodica è un documento in continua evoluzione. Nuovi elementi vengono sintetizzati o scoperti sperimentalmente, estendendo i confini della nostra comprensione della materia. La sintesi di elementi superpesanti, con numeri atomici superiori a 118, è un'area di ricerca attiva.
Esempio: Il Nihonio (Nh), numero atomico 113, è stato il primo elemento scoperto in Asia ed è stato chiamato in onore del Giappone (Nihon).
Conclusioni e Invito all'Azione
La Tavola Periodica degli Elementi è uno strumento essenziale per chiunque studi o lavori nel campo delle scienze. La sua organizzazione e le sue tendenze periodiche forniscono un quadro concettuale potente per comprendere il comportamento degli elementi e le loro interazioni. Esplorate la tavola periodica, approfondite le proprietà degli elementi e scoprite le infinite possibilità che offre. Continuate ad approfondire le vostre conoscenze in chimica e fisica, sfruttando la tavola periodica come guida per la scoperta e l'innovazione.
Incoraggiamo l'uso di risorse online interattive, libri di testo e lezioni per approfondire la comprensione della tavola periodica. La conoscenza degli elementi e delle loro proprietà è fondamentale per il successo in molti campi scientifici.