Tavola Periodica Degli Elementi Di Chimica

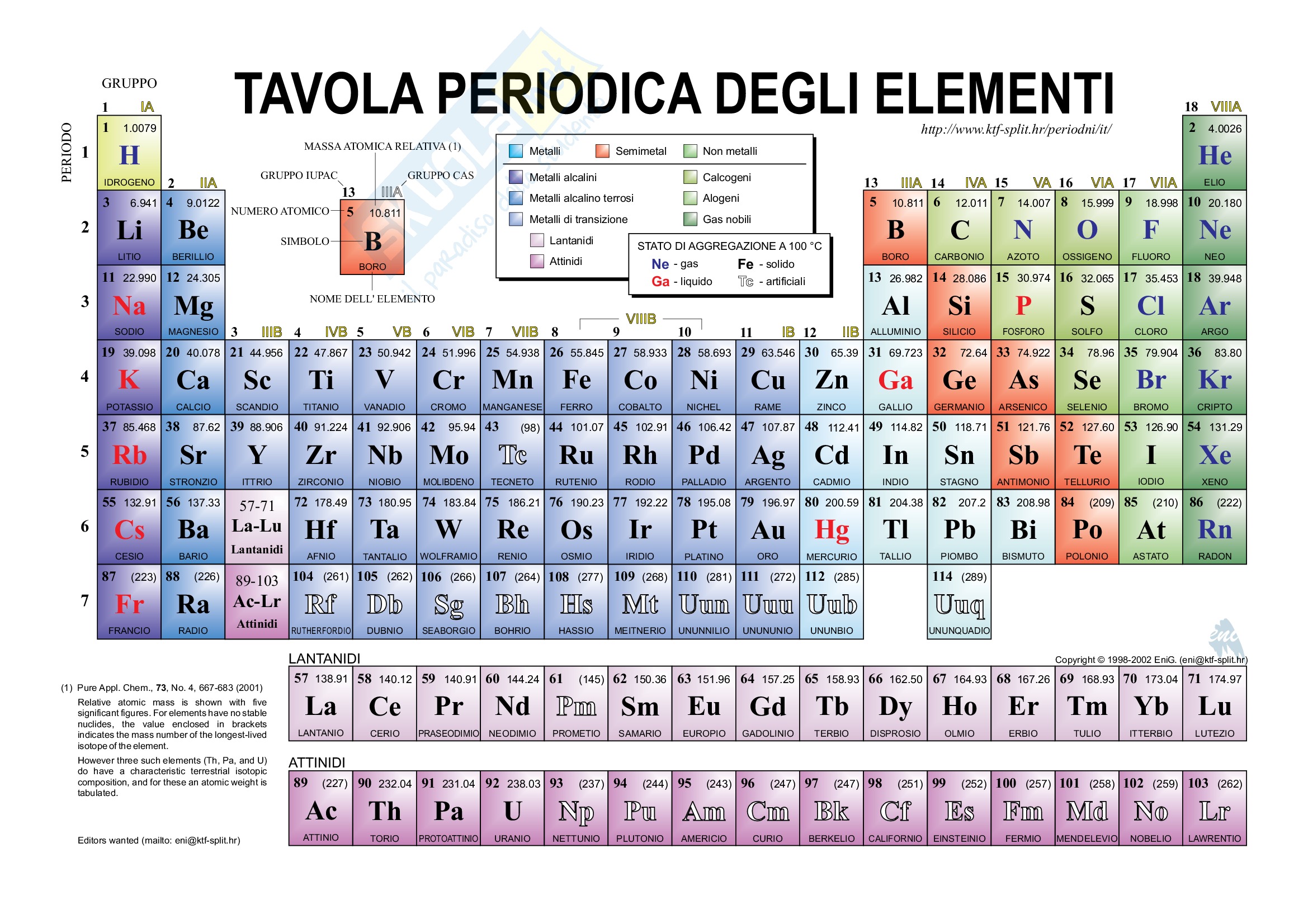
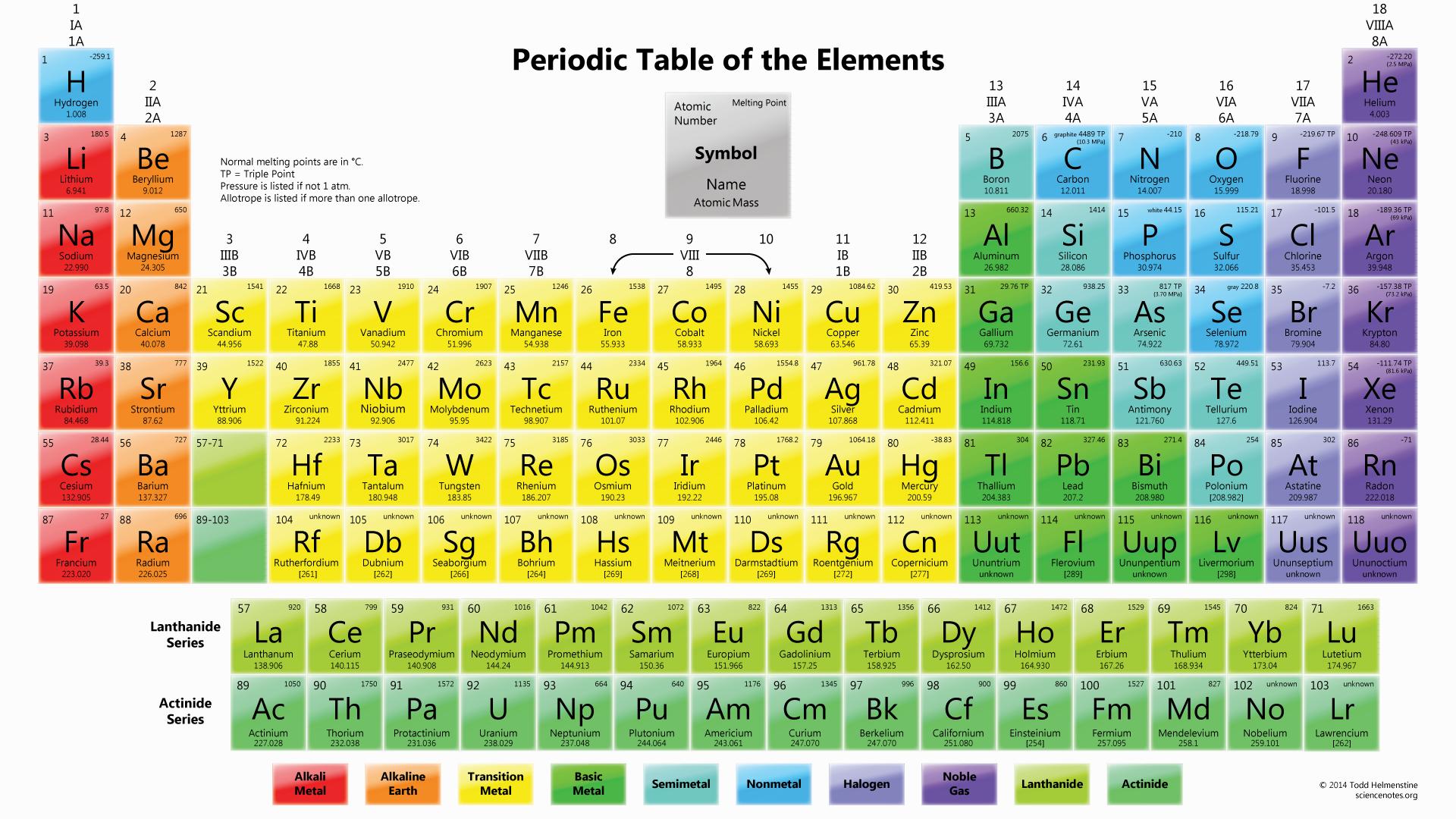
La Tavola Periodica degli Elementi, a volte semplicemente chiamata Tavola di Mendeleev, è una rappresentazione tabellare di tutti gli elementi chimici conosciuti. Non è solo un elenco, ma un sistema organizzato che rivela modelli e relazioni fondamentali tra le proprietà degli elementi. Capire la Tavola Periodica è cruciale per chiunque studi chimica, fisica, biologia, scienza dei materiali e molte altre discipline scientifiche.
Organizzazione e Struttura della Tavola Periodica
La tavola periodica è organizzata in righe orizzontali, chiamate periodi, e colonne verticali, chiamate gruppi o famiglie. L'ordine degli elementi è basato sul loro numero atomico (Z), ovvero il numero di protoni nel nucleo di un atomo. Aumentando il numero atomico, si passa da un elemento all'altro.
Periodi
Ci sono sette periodi nella tavola periodica, numerati da 1 a 7. Ogni periodo inizia con un elemento con un singolo elettrone nel suo guscio di valenza più esterno e termina con un gas nobile, che ha un guscio di valenza completo. Il numero del periodo indica il livello energetico più alto occupato dagli elettroni in quell'elemento. Ad esempio, gli elementi nel periodo 3 (come il sodio, il magnesio e l'alluminio) hanno i loro elettroni di valenza nel terzo livello energetico.
Gruppi
I gruppi (o famiglie) sono le colonne verticali della tavola periodica, e sono contrassegnate con numeri da 1 a 18. Gli elementi nello stesso gruppo hanno lo stesso numero di elettroni nel loro guscio di valenza (ad eccezione dell'elio e dell'idrogeno). Questa somiglianza nella configurazione elettronica di valenza determina le proprietà chimiche simili degli elementi all'interno dello stesso gruppo. Ad esempio, gli elementi del gruppo 1 (i metalli alcalini) sono tutti altamente reattivi con l'acqua, mentre gli elementi del gruppo 17 (gli alogeni) sono altamente reattivi con i metalli.
Blocchi
La tavola periodica è anche divisa in blocchi basati sulla configurazione elettronica degli elementi. Questi blocchi corrispondono agli orbitali atomici che vengono riempiti con gli elettroni di valenza: il blocco s, il blocco p, il blocco d e il blocco f. Il blocco s comprende i gruppi 1 e 2, il blocco p comprende i gruppi 13-18, il blocco d comprende i gruppi 3-12 (i metalli di transizione) e il blocco f comprende i lantanidi e gli attinidi (elementi di transizione interni), che sono tipicamente collocati separatamente nella parte inferiore della tavola.
Informazioni Fornite dalla Tavola Periodica
La Tavola Periodica fornisce una miriade di informazioni su ciascun elemento:
- Simbolo chimico: Una o due lettere che rappresentano l'elemento (es. H per idrogeno, O per ossigeno, Fe per ferro).
- Numero atomico (Z): Il numero di protoni nel nucleo. Determina l'identità dell'elemento.
- Massa atomica relativa (Ar): La massa media di un atomo dell'elemento, espressa in unità di massa atomica (uma). È una media ponderata delle masse degli isotopi naturali dell'elemento.
- Configurazione elettronica: La disposizione degli elettroni nei vari livelli energetici e orbitali. Influisce sulle proprietà chimiche dell'elemento.
- Elettronegatività: Una misura della capacità di un atomo di attrarre elettroni in un legame chimico.
- Raggio atomico: Una misura della dimensione di un atomo.
- Stato di ossidazione: Il numero di elettroni che un atomo ha guadagnato, perso o condiviso quando si lega con altri atomi.
Tendenze Periodiche
Una delle caratteristiche più importanti della tavola periodica è la presenza di tendenze periodiche, ovvero cambiamenti graduali nelle proprietà degli elementi man mano che ci si sposta attraverso la tavola.
Raggio Atomico
Il raggio atomico generalmente diminuisce da sinistra a destra lungo un periodo. Questo perché l'aumento del numero di protoni nel nucleo aumenta l'attrazione tra il nucleo e gli elettroni, tirandoli più vicino. Il raggio atomico generalmente aumenta scendendo lungo un gruppo. Questo perché si aggiungono nuovi livelli energetici, e gli elettroni più esterni sono quindi più lontani dal nucleo.
Energia di Ionizzazione
L'energia di ionizzazione è l'energia necessaria per rimuovere un elettrone da un atomo neutro in fase gassosa. L'energia di ionizzazione generalmente aumenta da sinistra a destra lungo un periodo. Questo perché l'aumento della carica nucleare effettiva rende più difficile rimuovere un elettrone. L'energia di ionizzazione generalmente diminuisce scendendo lungo un gruppo. Questo perché gli elettroni più esterni sono più lontani dal nucleo e quindi più facili da rimuovere.
Elettronegatività
L'elettronegatività generalmente aumenta da sinistra a destra lungo un periodo. Questo perché gli atomi diventano più attrattivi agli elettroni man mano che la carica nucleare effettiva aumenta. L'elettronegatività generalmente diminuisce scendendo lungo un gruppo. Questo perché gli elettroni di valenza sono più lontani dal nucleo e quindi meno fortemente attratti.
Carattere Metallico
Il carattere metallico generalmente diminuisce da sinistra a destra lungo un periodo. Questo perché gli elementi diventano più elettronegativi e meno inclini a perdere elettroni. Il carattere metallico generalmente aumenta scendendo lungo un gruppo. Questo perché gli elettroni di valenza sono più lontani dal nucleo e quindi più facili da rimuovere.
Applicazioni Pratiche
La Tavola Periodica è uno strumento indispensabile in moltissimi campi. Alcuni esempi includono:
- Sintesi di nuovi materiali: La conoscenza delle proprietà degli elementi e delle loro combinazioni consente agli scienziati di progettare e sintetizzare nuovi materiali con proprietà specifiche. Ad esempio, la combinazione di titanio e alluminio crea leghe leggere e resistenti utilizzate nell'industria aerospaziale.
- Progettazione di farmaci: La comprensione della struttura e della reattività delle molecole permette ai chimici farmaceutici di sviluppare farmaci che interagiscono in modo specifico con bersagli biologici.
- Analisi ambientale: La tavola periodica è utilizzata per identificare e quantificare gli elementi presenti in campioni ambientali, come acqua, suolo e aria. Questo aiuta a monitorare la contaminazione e a sviluppare strategie di bonifica. Ad esempio, il monitoraggio del livello di mercurio nell'acqua potabile.
- Diagnostica medica: Elementi come il tecnezio-99m sono utilizzati in medicina nucleare per la diagnostica per immagini.
- Produzione di energia: Elementi come l'uranio sono utilizzati come combustibile nelle centrali nucleari per la produzione di energia.
Esempi Concreti e Dati
Consideriamo alcuni esempi specifici:
- Litio (Li): Un metallo alcalino nel gruppo 1, ampiamente utilizzato nelle batterie per dispositivi elettronici portatili e veicoli elettrici. La sua piccola dimensione atomica e la sua elevata energia di ionizzazione lo rendono ideale per questo scopo.
- Oro (Au): Un metallo di transizione nel gruppo 11, noto per la sua elevata resistenza alla corrosione e la sua eccellente conduttività elettrica. Viene utilizzato in gioielleria, elettronica e odontoiatria. La sua configurazione elettronica lo rende relativamente inerte.
- Cloro (Cl): Un alogeno nel gruppo 17, utilizzato come disinfettante nell'acqua potabile e nelle piscine. La sua elevata elettronegatività lo rende un potente ossidante.
- Silicio (Si): Un metalloide nel gruppo 14, è il componente principale dei semiconduttori utilizzati nei chip dei computer e nei dispositivi elettronici. La sua capacità di formare legami covalenti lo rende un materiale semiconduttore ideale.
Per esempio, confrontiamo il raggio atomico del sodio (Na) e del cloro (Cl), entrambi nel periodo 3. Il sodio ha un raggio atomico di 190 pm, mentre il cloro ha un raggio atomico di 99 pm. Questa differenza è dovuta all'aumento della carica nucleare effettiva da sinistra a destra lungo il periodo.
Conclusioni
La Tavola Periodica degli Elementi è molto più di un semplice elenco. È una mappa dettagliata dell'universo chimico, che rivela le relazioni fondamentali tra gli elementi e le loro proprietà. Comprendere la struttura e le tendenze della Tavola Periodica è essenziale per chiunque si avvicini allo studio della chimica e delle scienze correlate. Continuare ad esplorare le proprietà e le interazioni degli elementi è fondamentale per lo sviluppo di nuove tecnologie, materiali e soluzioni ai problemi globali.
Approfondisci la tua conoscenza! Esplora le risorse online, partecipa a corsi di chimica, e sperimenta con i principi della Tavola Periodica. La comprensione di questa mappa fondamentale ti aprirà le porte a un mondo di scoperte scientifiche.