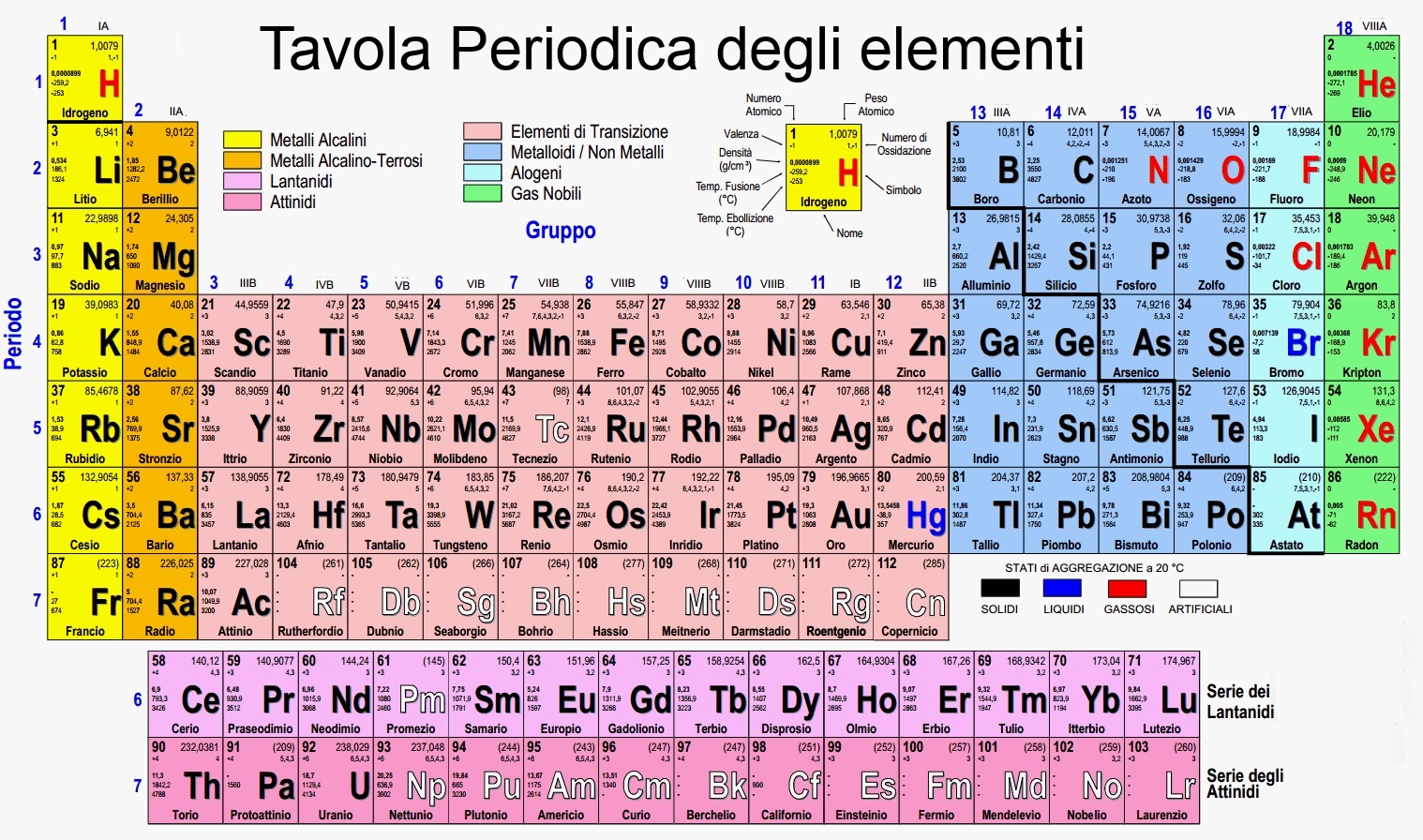
Tavola Periodica Con Numero Di Ossidazione

La tavola periodica è uno strumento fondamentale nella chimica, organizzando gli elementi in base alle loro proprietà chimiche e numero atomico. Un aspetto cruciale per comprendere il comportamento degli elementi è il loro numero di ossidazione (o stato di ossidazione). Questo articolo esplorerà in dettaglio il concetto di numero di ossidazione, la sua relazione con la tavola periodica e la sua importanza nelle reazioni chimiche.
Cos'è il Numero di Ossidazione?
Il numero di ossidazione è una carica ipotetica che un atomo assumerebbe se tutti i suoi legami con altri atomi fossero puramente ionici. È un concetto utile per tenere traccia del trasferimento di elettroni nelle reazioni redox (ossidoriduzione). Non è una carica reale, ma piuttosto un modo per descrivere la distribuzione degli elettroni in una molecola o ione.
Importante: Il numero di ossidazione può essere positivo, negativo o zero. Un numero di ossidazione positivo indica che l'atomo ha "perso" elettroni (o ha condiviso elettroni con un atomo più elettronegativo), mentre un numero di ossidazione negativo indica che l'atomo ha "guadagnato" elettroni (o ha condiviso elettroni con un atomo meno elettronegativo).
Regole per Determinare i Numeri di Ossidazione
Ci sono alcune regole generali che ci aiutano a determinare i numeri di ossidazione:
- Il numero di ossidazione di un elemento allo stato elementare è sempre 0 (es. Na(s), O2(g), Cu(s)).
- Il numero di ossidazione di uno ione monoatomico è uguale alla sua carica (es. Na+ ha numero di ossidazione +1, Cl- ha numero di ossidazione -1).
- La somma dei numeri di ossidazione di tutti gli atomi in una molecola neutra è 0.
- La somma dei numeri di ossidazione di tutti gli atomi in uno ione poliatomico è uguale alla carica dello ione.
- Il fluoro (F) ha sempre un numero di ossidazione di -1 nei suoi composti.
- L'ossigeno (O) ha solitamente un numero di ossidazione di -2. Ci sono eccezioni, come nei perossidi (es. H2O2), dove ha un numero di ossidazione di -1, e quando è legato al fluoro (es. OF2), dove ha un numero di ossidazione positivo.
- L'idrogeno (H) ha solitamente un numero di ossidazione di +1. L'eccezione è quando è legato a un metallo, formando idruri metallici (es. NaH), dove ha un numero di ossidazione di -1.
- I metalli alcalini (Gruppo 1) hanno sempre un numero di ossidazione di +1 nei loro composti.
- I metalli alcalino-terrosi (Gruppo 2) hanno sempre un numero di ossidazione di +2 nei loro composti.
La Tavola Periodica e i Numeri di Ossidazione
La posizione di un elemento nella tavola periodica fornisce indicazioni utili sui suoi numeri di ossidazione più comuni. Ciò è legato alla configurazione elettronica degli atomi e alla loro tendenza a raggiungere una configurazione stabile (come quella dei gas nobili).
Gruppi Principali
- Gruppo 1 (Metalli Alcalini): Tendono a perdere un elettrone per formare ioni con carica +1, quindi il loro numero di ossidazione è +1.
- Gruppo 2 (Metalli Alcalino-Terrosi): Tendono a perdere due elettroni per formare ioni con carica +2, quindi il loro numero di ossidazione è +2.
- Gruppo 13 (Gruppo del Boro): Il boro (B) mostra principalmente un numero di ossidazione +3. Alluminio (Al) tende ad avere +3. Gli altri elementi possono mostrare anche numeri di ossidazione inferiori.
- Gruppo 14 (Gruppo del Carbonio): Il carbonio (C) può presentare numeri di ossidazione che vanno da -4 a +4, a seconda del composto. Silicio (Si) tende a +4.
- Gruppo 15 (Gruppo dell'Azoto): L'azoto (N) ha una gamma di numeri di ossidazione, tra cui -3, -2, -1, 0, +1, +2, +3, +4, +5.
- Gruppo 16 (Gruppo dell'Ossigeno): L'ossigeno (O) solitamente ha un numero di ossidazione -2, con le eccezioni già menzionate.
- Gruppo 17 (Alogeni): Gli alogeni (F, Cl, Br, I) solitamente hanno un numero di ossidazione -1, ma possono avere numeri di ossidazione positivi quando legati a ossigeno o fluoro.
- Gruppo 18 (Gas Nobili): Generalmente inerti, ma alcuni gas nobili pesanti possono formare composti con il fluoro e l'ossigeno, mostrando numeri di ossidazione positivi.
Metalli di Transizione
I metalli di transizione (elementi del blocco d della tavola periodica) mostrano una maggiore varietà di numeri di ossidazione rispetto ai gruppi principali. Questo è dovuto alla presenza di elettroni negli orbitali d, che possono essere coinvolti nel legame chimico in modi diversi. Ad esempio:
- Il ferro (Fe) può esistere con numeri di ossidazione +2 (ferroso) e +3 (ferrico).
- Il manganese (Mn) può presentare numeri di ossidazione che vanno da +2 a +7.
- Il cromo (Cr) può presentare numeri di ossidazione che vanno da +2 a +6.
La molteplicità dei numeri di ossidazione dei metalli di transizione è fondamentale per la loro attività catalitica e per la formazione di composti colorati.
Applicazioni Pratiche e Esempi
La conoscenza dei numeri di ossidazione è essenziale per diverse applicazioni pratiche, tra cui:
- Bilanciamento delle reazioni redox: Determinare i numeri di ossidazione degli elementi coinvolti in una reazione redox è fondamentale per bilanciare correttamente l'equazione chimica.
- Previsione della reattività: I numeri di ossidazione possono aiutare a prevedere quali elementi o composti possono agire come agenti ossidanti (accettano elettroni) o agenti riducenti (donano elettroni).
- Nomenclatura chimica: I numeri di ossidazione sono utilizzati nella nomenclatura di alcuni composti chimici, specialmente quelli contenenti metalli di transizione (es. ossido di ferro(II) per FeO, ossido di ferro(III) per Fe2O3).
- Elettrochimica: Lo studio delle reazioni redox è alla base dell'elettrochimica, che trova applicazioni nelle batterie, nelle celle a combustibile e nell'elettrolisi.
Esempi Concreti
Consideriamo la reazione tra zinco (Zn) e acido cloridrico (HCl):
Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g)
Analizziamo i numeri di ossidazione:
- Zn(s): 0
- H in HCl: +1
- Cl in HCl: -1
- Zn in ZnCl2: +2
- Cl in ZnCl2: -1
- H2(g): 0
Lo zinco passa da un numero di ossidazione 0 a +2, quindi viene ossidato (perde elettroni). L'idrogeno passa da un numero di ossidazione +1 a 0, quindi viene ridotto (guadagna elettroni). Il cloro rimane con un numero di ossidazione -1 e non partecipa alla reazione redox.
Un altro esempio è la reazione di combustione del metano (CH4):
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
Analizziamo i numeri di ossidazione:
- C in CH4: -4
- H in CH4: +1
- O2(g): 0
- C in CO2: +4
- O in CO2: -2
- H in H2O: +1
- O in H2O: -2
Il carbonio passa da un numero di ossidazione -4 a +4, quindi viene ossidato. L'ossigeno passa da un numero di ossidazione 0 a -2, quindi viene ridotto.
Limitazioni e Considerazioni
È importante ricordare che il numero di ossidazione è un concetto semplificato. Non rappresenta la carica reale degli atomi in una molecola, specialmente nei composti covalenti. È uno strumento utile per tenere traccia del trasferimento di elettroni, ma non deve essere interpretato letteralmente come una carica effettiva.
Inoltre, alcuni elementi possono presentare numeri di ossidazione non interi in alcuni composti complessi. Questi casi richiedono un'analisi più approfondita della struttura elettronica e del legame chimico.
Conclusione
La comprensione dei numeri di ossidazione e della loro relazione con la tavola periodica è fondamentale per lo studio della chimica. Questo concetto ci permette di prevedere la reattività degli elementi, bilanciare le reazioni redox e comprendere la nomenclatura dei composti chimici. Sebbene sia una semplificazione della realtà, il numero di ossidazione è uno strumento potente per analizzare e interpretare le reazioni chimiche. Approfondire questo argomento ti darà una solida base per affrontare concetti chimici più avanzati. Studia la tavola periodica, esercitati a calcolare i numeri di ossidazione e osserva come cambiano durante le reazioni chimiche. La chimica ti sembrerà molto più chiara e interessante!