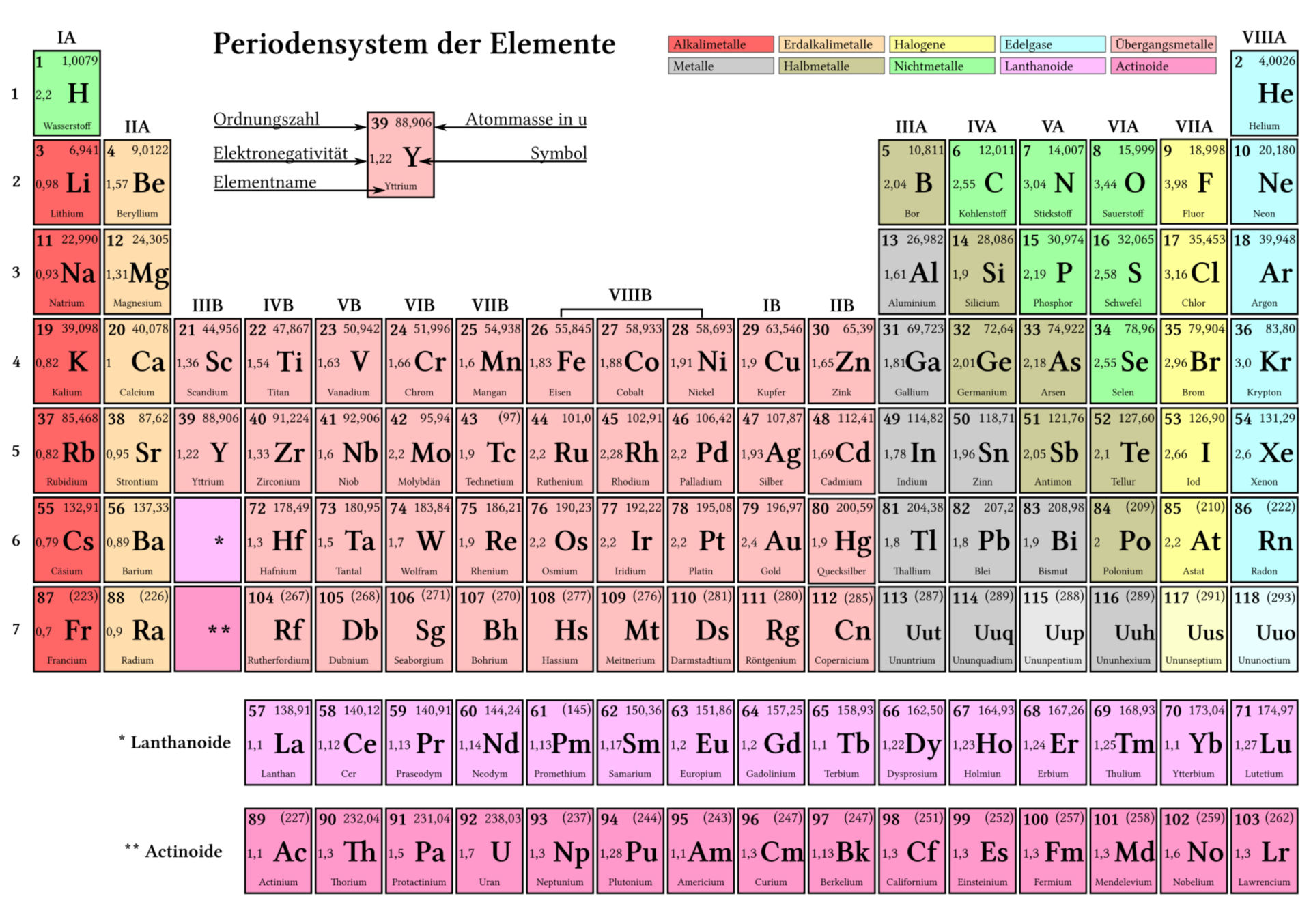
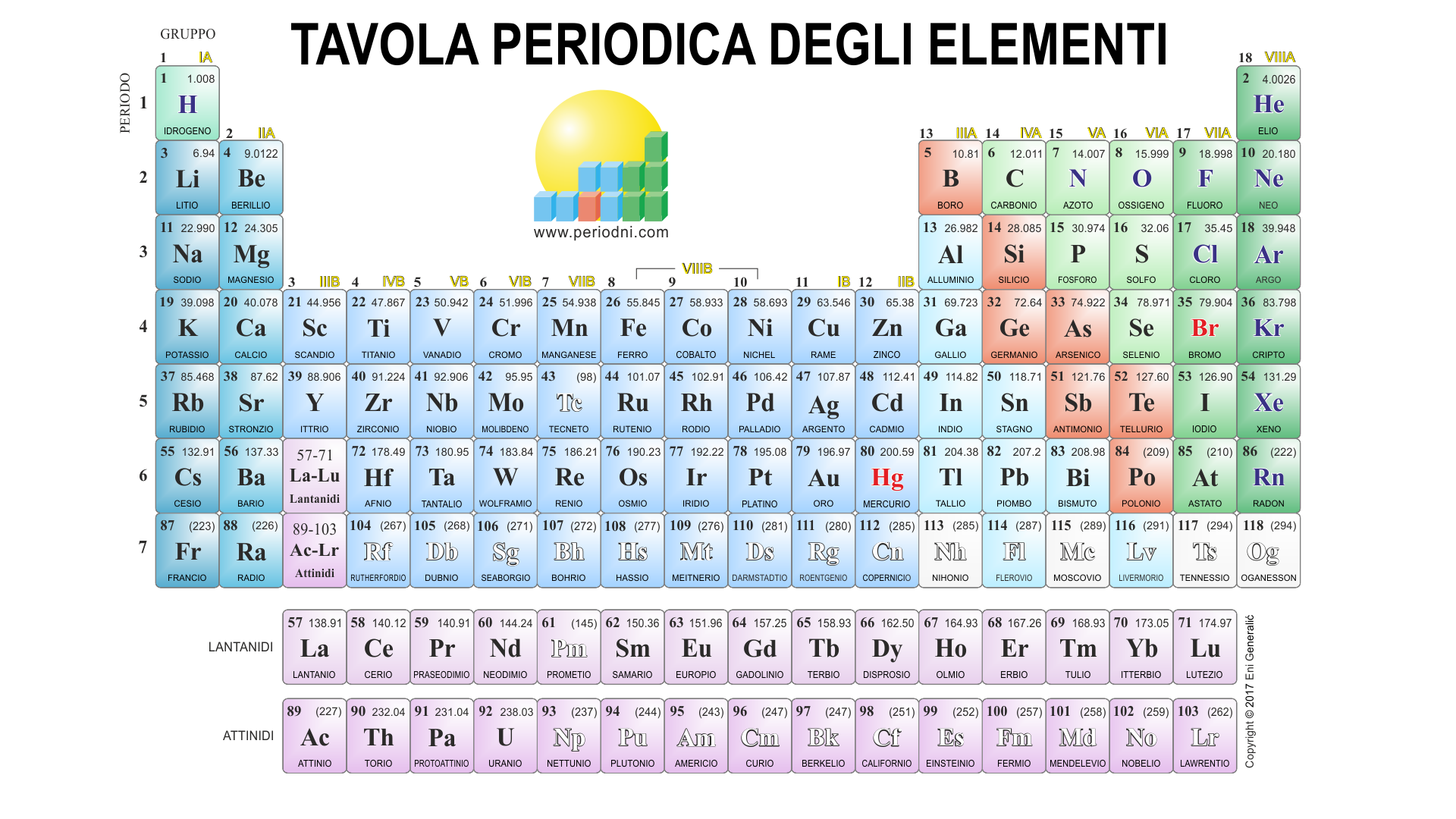
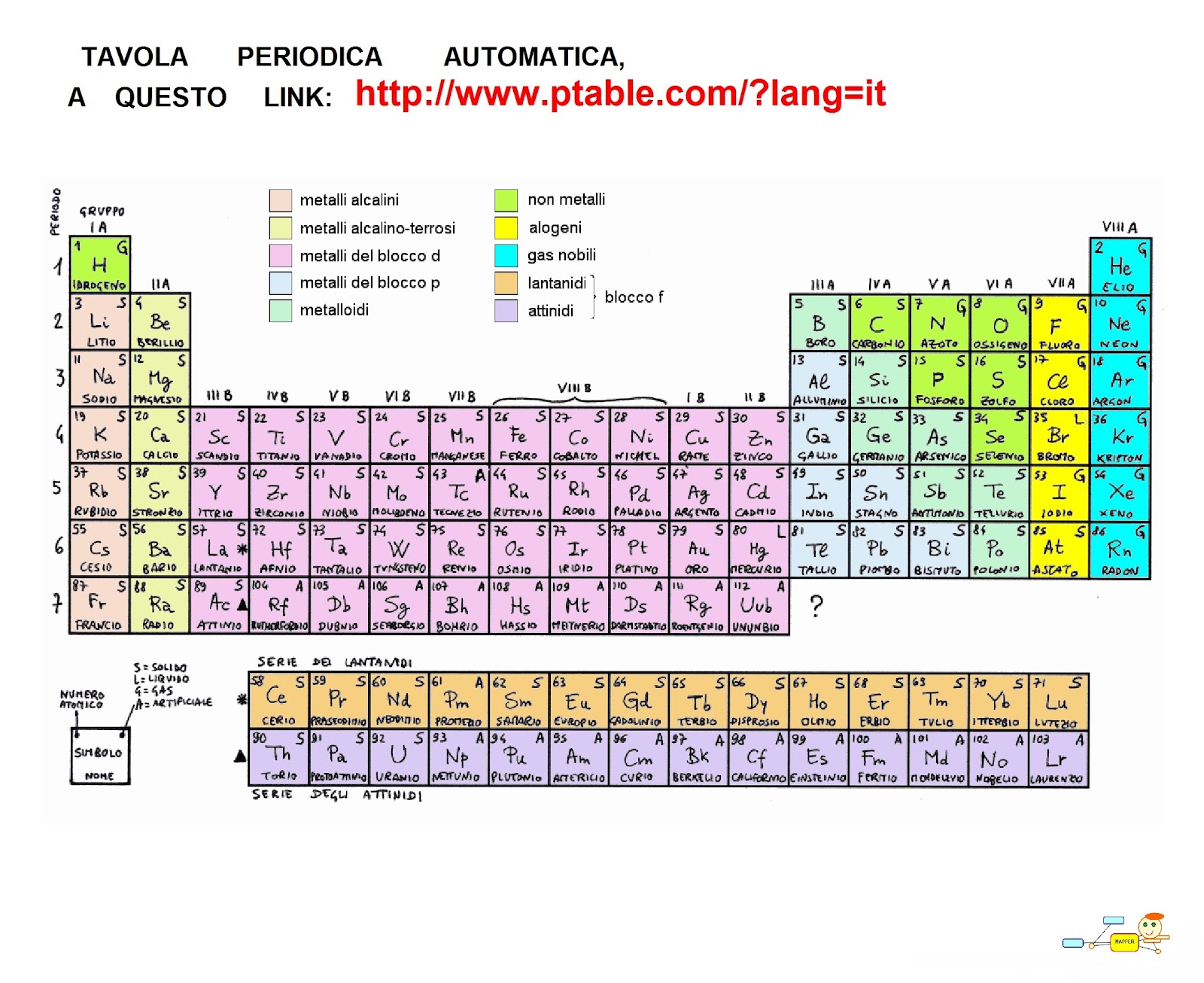
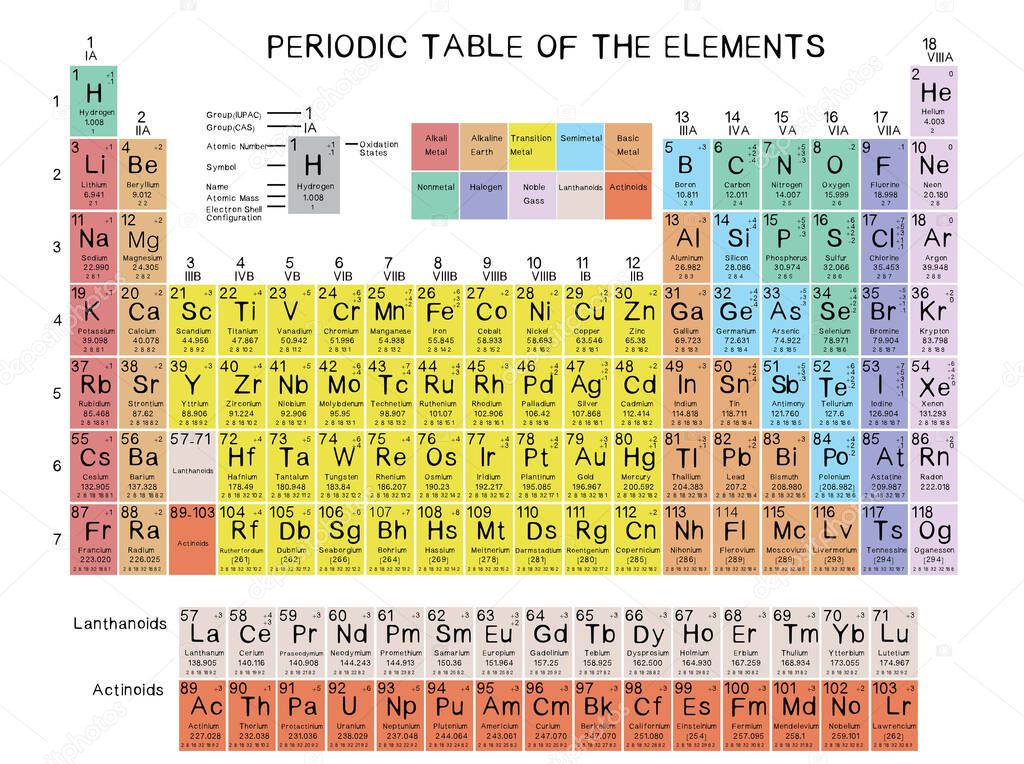
Tavola Periodica Con Numeri Di Ossidazione

La tavola periodica degli elementi è uno strumento fondamentale in chimica, fornendo un'organizzazione sistematica degli elementi in base al loro numero atomico e alle loro proprietà chimiche. Tuttavia, per comprendere appieno la reattività degli elementi e la formazione dei composti, è essenziale considerare anche i loro numeri di ossidazione.
Comprendere i Numeri di Ossidazione
Definizione e Significato
Il numero di ossidazione (o stato di ossidazione) rappresenta la carica ipotetica che un atomo avrebbe se tutti i legami fossero ionici. In altre parole, è il numero di elettroni che un atomo cederebbe o acquisterebbe quando si lega ad altri atomi. È importante sottolineare che il numero di ossidazione è un concetto convenzionale e non sempre corrisponde alla carica effettiva presente sull'atomo in una molecola.
Un numero di ossidazione positivo indica che l'atomo ha perso elettroni (o li ha condivisi in modo disuguale, attraendone meno di quelli che possedeva isolato), mentre un numero di ossidazione negativo indica che l'atomo ha guadagnato elettroni (o li ha condivisi in modo disuguale, attraendone di più di quelli che possedeva isolato). Un numero di ossidazione pari a zero indica che l'atomo è in forma elementare o che la distribuzione degli elettroni è considerata neutra.
Regole per Determinare i Numeri di Ossidazione
Esistono alcune regole generali che facilitano la determinazione dei numeri di ossidazione:
- Il numero di ossidazione di un elemento allo stato elementare è sempre zero (es. O2, Cu, Fe).
- Il numero di ossidazione di uno ione monoatomico è uguale alla sua carica (es. Na+ ha numero di ossidazione +1, Cl- ha numero di ossidazione -1).
- L'idrogeno (H) ha numero di ossidazione +1 nella maggior parte dei composti, tranne negli idruri metallici dove ha numero di ossidazione -1 (es. NaH).
- L'ossigeno (O) ha numero di ossidazione -2 nella maggior parte dei composti, tranne nei perossidi (es. H2O2) dove ha numero di ossidazione -1 e nel OF2 dove è +2.
- La somma dei numeri di ossidazione di tutti gli atomi in una molecola neutra è zero.
- La somma dei numeri di ossidazione di tutti gli atomi in uno ione poliatomico è uguale alla carica dello ione.
La Tavola Periodica e i Numeri di Ossidazione
Variazioni Periodiche
La posizione di un elemento nella tavola periodica fornisce indicazioni sui suoi possibili numeri di ossidazione. In generale:
- I metalli alcalini (gruppo 1) hanno un numero di ossidazione predominante di +1.
- I metalli alcalino-terrosi (gruppo 2) hanno un numero di ossidazione predominante di +2.
- Gli alogeni (gruppo 17) hanno un numero di ossidazione predominante di -1 (tranne quando si combinano con ossigeno o altri alogeni più elettronegativi).
- I calcogeni (gruppo 16) hanno un numero di ossidazione predominante di -2 (tranne quando si combinano con ossigeno o alogeni più elettronegativi).
Gli elementi del blocco d (metalli di transizione) mostrano una maggiore varietà di numeri di ossidazione, a causa della configurazione elettronica dei loro orbitali d. Questo rende la loro chimica particolarmente ricca e complessa.
Esempi Specifici
Consideriamo alcuni esempi:
- Ferro (Fe): Può esistere con numeri di ossidazione +2 (ione ferroso, Fe2+) e +3 (ione ferrico, Fe3+). Ad esempio, nell'ossido ferroso (FeO) il ferro ha numero di ossidazione +2, mentre nell'ossido ferrico (Fe2O3) il ferro ha numero di ossidazione +3. Questa variazione è cruciale in processi biologici come il trasporto di ossigeno nell'emoglobina.
- Manganese (Mn): Presenta una gamma ancora più ampia di numeri di ossidazione, da +2 a +7. Ad esempio, nel permanganato di potassio (KMnO4), il manganese ha numero di ossidazione +7 ed è un potente ossidante.
- Zolfo (S): Può assumere numeri di ossidazione da -2 a +6. Nel solfuro di idrogeno (H2S) ha numero di ossidazione -2, mentre nell'acido solforico (H2SO4) ha numero di ossidazione +6.
Applicazioni Pratiche dei Numeri di Ossidazione
Nomenclatura dei Composti Chimici
I numeri di ossidazione sono essenziali per la nomenclatura dei composti chimici, specialmente per quelli contenenti elementi con più di un possibile numero di ossidazione. Ad esempio, per distinguere tra FeO (ossido di ferro(II) o ossido ferroso) e Fe2O3 (ossido di ferro(III) o ossido ferrico), si utilizzano i numeri romani tra parentesi per indicare il numero di ossidazione del ferro.
Reazioni Redox
I numeri di ossidazione sono fondamentali per comprendere le reazioni di ossido-riduzione (redox). Una reazione redox è una reazione chimica in cui si verifica un trasferimento di elettroni tra le specie reagenti. L'elemento che perde elettroni si dice che si ossida (il suo numero di ossidazione aumenta), mentre l'elemento che acquista elettroni si dice che si riduce (il suo numero di ossidazione diminuisce). Riconoscere le variazioni dei numeri di ossidazione permette di bilanciare correttamente le equazioni redox e di prevedere la spontaneità delle reazioni.
Esempi Reali
Consideriamo alcuni esempi di applicazioni pratiche:
- Corrosione dei metalli: La corrosione del ferro (formazione della ruggine) è un processo redox in cui il ferro si ossida (Fe → Fe2+ + 2e-) in presenza di ossigeno e acqua. Comprendere questo processo permette di sviluppare metodi per proteggere i metalli dalla corrosione, come la galvanizzazione o l'applicazione di vernici protettive.
- Processi biologici: La respirazione cellulare è un processo redox fondamentale per la vita, in cui il glucosio viene ossidato per produrre energia. L'ossigeno agisce come accettore finale di elettroni, riducendosi ad acqua.
- Produzione di energia: Le batterie funzionano grazie a reazioni redox controllate. Ad esempio, in una batteria zinco-rame (cella Daniell), lo zinco si ossida e il rame si riduce, generando una corrente elettrica.
- Trattamento delle acque reflue: I processi di ossidazione e riduzione sono utilizzati per rimuovere contaminanti dalle acque reflue. Ad esempio, l'ozono (O3) è un potente ossidante che può essere utilizzato per degradare sostanze organiche inquinanti.
Considerazioni Avanzate
Eccezioni e Complessità
Nonostante le regole generali, esistono alcune eccezioni e casi complessi nella determinazione dei numeri di ossidazione. Ad esempio, in alcuni composti, la struttura molecolare o la natura dei legami possono rendere difficile l'assegnazione di numeri di ossidazione univoci. Inoltre, la risonanza e la delocalizzazione elettronica possono complicare ulteriormente il quadro.
Importanza della Elettronegatività
La elettronegatività degli elementi gioca un ruolo cruciale nella determinazione dei numeri di ossidazione. L'elemento più elettronegativo in un composto tenderà ad attrarre gli elettroni verso di sé, assumendo un numero di ossidazione negativo, mentre l'elemento meno elettronegativo tenderà a cedere gli elettroni, assumendo un numero di ossidazione positivo.
Conclusione
La tavola periodica con i numeri di ossidazione è uno strumento indispensabile per chimici, studenti e professionisti che lavorano con materiali e reazioni chimiche. La comprensione dei numeri di ossidazione permette di predire la reattività degli elementi, di nominare correttamente i composti, di bilanciare le equazioni redox e di comprendere i processi chimici che avvengono in natura e nelle applicazioni tecnologiche. Investire tempo nello studio e nella padronanza di questo concetto è un passo fondamentale per acquisire una solida base in chimica.
Invitiamo quindi tutti gli studenti e gli appassionati di chimica ad approfondire ulteriormente lo studio dei numeri di ossidazione, consultando libri di testo, risorse online e svolgendo esercizi pratici. Una comprensione approfondita di questo argomento aprirà le porte a una comprensione più profonda e significativa della chimica e del mondo che ci circonda.