Stabilisci La Geometria Della Molecola H2s

Hai mai sentito parlare dell'idrogeno solforato (H2S)? Forse l'hai incontrato in forma di quel fastidioso odore di uova marce che a volte senti. Ma al di là del suo odore pungente, l'H2S è una molecola interessante con una geometria specifica che influenza le sue proprietà chimiche. Questo articolo è pensato per chiunque sia curioso di chimica, dagli studenti delle superiori agli appassionati di scienza, e ha l'obiettivo di spiegare come determinare la geometria di questa molecola in modo chiaro e comprensibile.
Introduzione alla Geometria Molecolare
Prima di addentrarci nell'H2S, è fondamentale capire cosa si intende per geometria molecolare. Essa descrive la disposizione tridimensionale degli atomi in una molecola. Questa disposizione non è casuale; è determinata dalle forze repulsive tra le coppie di elettroni, sia quelle coinvolte nei legami chimici (coppie leganti) sia quelle non coinvolte (coppie solitarie, o lone pairs).
Il modello più comunemente utilizzato per prevedere la geometria molecolare è la teoria VSEPR (Valence Shell Electron Pair Repulsion), ovvero la Repulsione delle Coppie Elettroniche del Guscio di Valenza. Questa teoria si basa sull'idea che le coppie di elettroni si respingono a vicenda e, di conseguenza, si dispongono nello spazio in modo da minimizzare questa repulsione. Il risultato è una disposizione specifica degli atomi che definisce la forma della molecola.
Determinazione della Geometria di H2S
Ora applichiamo la teoria VSEPR per determinare la geometria della molecola H2S. Seguiamo questi passaggi:
1. Disegna la Struttura di Lewis
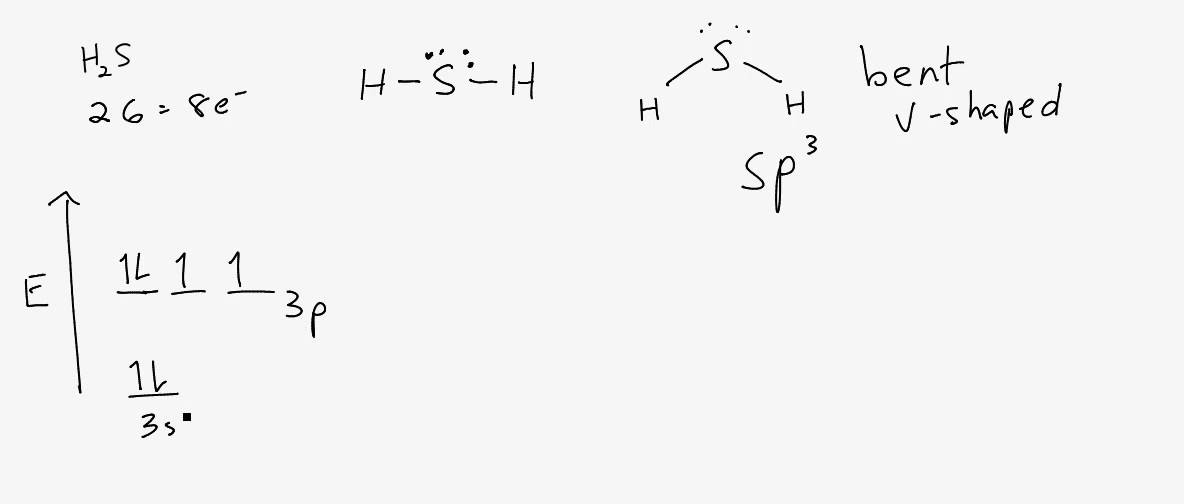
Il primo passo è disegnare la struttura di Lewis per H2S.
- L'atomo di zolfo (S) è l'atomo centrale perché è meno elettronegativo dell'idrogeno (H).
- Lo zolfo ha 6 elettroni di valenza.
- Ogni atomo di idrogeno ha 1 elettrone di valenza.
- Il numero totale di elettroni di valenza nella molecola è 6 + 1 + 1 = 8.
Nella struttura di Lewis, lo zolfo forma un legame covalente singolo con ciascuno dei due atomi di idrogeno. Questo usa 4 degli 8 elettroni di valenza, lasciando 4 elettroni non legati, che formano due coppie solitarie sull'atomo di zolfo.
La struttura di Lewis si presenta quindi con l'atomo di zolfo al centro, legato a due atomi di idrogeno e con due coppie di elettroni non condivise sull'atomo di zolfo.
2. Conta i Gruppi di Elettroni Intorno all'Atomo Centrale
Un gruppo di elettroni può essere un atomo legato, una coppia solitaria o un legame multiplo (doppio o triplo). Nel caso di H2S, l'atomo di zolfo ha:
- Due legami singoli con gli atomi di idrogeno (due gruppi leganti).
- Due coppie solitarie (due gruppi non leganti).
In totale, ci sono quindi quattro gruppi di elettroni attorno all'atomo di zolfo.
3. Determina la Geometria Elettronica
La geometria elettronica descrive la disposizione dei gruppi di elettroni attorno all'atomo centrale, considerando sia le coppie leganti che quelle solitarie. Quando ci sono quattro gruppi di elettroni, la geometria elettronica è tetraedrica. Immagina un tetraedro, con l'atomo di zolfo al centro e i quattro gruppi di elettroni che puntano verso i vertici del tetraedro.
4. Determina la Geometria Molecolare
La geometria molecolare descrive la disposizione degli atomi nella molecola, ignorando le coppie solitarie. Nel caso di H2S, abbiamo una geometria elettronica tetraedrica, ma solo due atomi di idrogeno legati all'atomo di zolfo. Le due coppie solitarie "spingono" i legami S-H verso il basso, riducendo l'angolo di legame rispetto a un tetraedro perfetto (109.5°).
Di conseguenza, la geometria molecolare di H2S è angolata o piegata (bent). Immagina l'acqua (H2O), che ha una geometria simile a causa della presenza di due coppie solitarie sull'ossigeno. La differenza principale è che l'angolo di legame in H2S è più piccolo di quello in H2O (circa 92° contro 104.5°) a causa della minore elettronegatività dello zolfo rispetto all'ossigeno, che rende le coppie solitarie sull'atomo di zolfo più diffuse e quindi più repulsive.
Conseguenze della Geometria Angolata
La geometria angolata di H2S ha importanti conseguenze per le sue proprietà fisiche e chimiche:
- Polarità: La molecola di H2S è polare. Questo significa che ha un momento dipolare netto, con una parziale carica negativa sull'atomo di zolfo e parziali cariche positive sugli atomi di idrogeno. La polarità deriva dalla differenza di elettronegatività tra zolfo e idrogeno e dalla forma angolata della molecola. Se la molecola fosse lineare, i dipoli di legame si annullerebbero a vicenda, rendendo la molecola non polare.
- Solubilità: La polarità di H2S influisce sulla sua solubilità in acqua. Sebbene non sia altamente solubile, la polarità consente alcune interazioni favorevoli con le molecole d'acqua polari.
- Reattività: La presenza di coppie solitarie sull'atomo di zolfo rende H2S un nucleofilo, cioè una specie chimica che è attratta da cariche positive e può donare un paio di elettroni per formare un legame chimico.
Applicazioni e Importanza di H2S
Nonostante il suo odore sgradevole, l'H2S ha diverse applicazioni importanti:
- Industria chimica: È utilizzato come reagente nella produzione di vari composti chimici, tra cui acido solforico e zolfo elementare.
- Geotermia: È presente nei fluidi geotermici e può essere utilizzato per generare energia elettrica.
- Biologia: A basse concentrazioni, l'H2S svolge un ruolo importante nella segnalazione cellulare e nella regolazione di vari processi biologici. Tuttavia, ad alte concentrazioni, è tossico.
Comprendere la geometria molecolare di H2S non solo ci aiuta a prevedere le sue proprietà, ma anche a capire il suo comportamento in diverse reazioni chimiche e contesti ambientali.
Conclusione
Abbiamo esplorato la geometria della molecola di H2S utilizzando la teoria VSEPR. Abbiamo visto come la struttura di Lewis, il conteggio dei gruppi di elettroni e la repulsione tra coppie elettroniche determinano una geometria molecolare angolata. Questa geometria, a sua volta, influenza la polarità, la solubilità e la reattività di H2S. Speriamo che questa spiegazione ti abbia aiutato a comprendere meglio la relazione tra la struttura molecolare e le proprietà chimiche di questo composto interessante e importante.
La prossima volta che senti l'odore di uova marce, ricorda che dietro quell'odore sgradevole si nasconde una molecola con una geometria affascinante! Continua ad esplorare il mondo della chimica e scoprirai sempre nuove meraviglie!