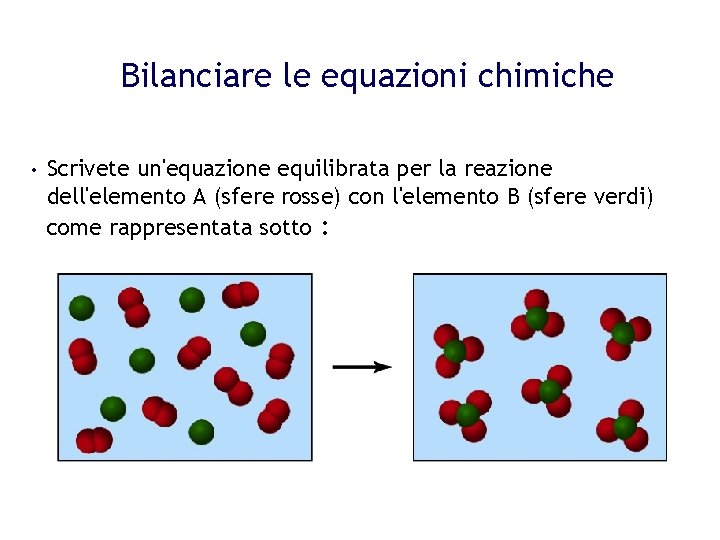
Reazioni Chimiche Da Bilanciare Esercizi Con Soluzioni

Il bilanciamento delle reazioni chimiche è un'abilità fondamentale in chimica. Non si tratta semplicemente di un esercizio matematico; è la chiave per comprendere e prevedere come le sostanze interagiscono a livello molecolare. Senza un corretto bilanciamento, le equazioni chimiche diventano inutili, incapaci di fornire informazioni accurate sulle quantità relative di reagenti e prodotti coinvolti in una reazione. In questo articolo, esploreremo in dettaglio l'importanza del bilanciamento delle reazioni chimiche, i metodi più comuni utilizzati e forniremo una serie di esercizi con soluzioni per mettere in pratica queste conoscenze.
Perché Bilanciare le Reazioni Chimiche?
Il bilanciamento delle reazioni chimiche si basa su un principio fondamentale: la legge di conservazione della massa. Questa legge afferma che la materia non può essere creata né distrutta in una reazione chimica. In altre parole, il numero di atomi di ciascun elemento deve essere lo stesso sia nei reagenti (le sostanze che reagiscono) che nei prodotti (le sostanze che si formano). Un'equazione chimica non bilanciata viola questa legge, suggerendo erroneamente che gli atomi possono scomparire o apparire dal nulla.
Un'equazione bilanciata ci permette di:
- Calcolare i rapporti stechiometrici: Determinare le quantità relative di reagenti e prodotti necessari per una reazione.
- Prevedere la resa teorica: Stimare la quantità massima di prodotto che si può ottenere da una determinata quantità di reagenti.
- Comprendere il meccanismo di reazione: Anche se il bilanciamento non rivela direttamente il meccanismo, fornisce un quadro coerente delle trasformazioni che avvengono a livello molecolare.
L'Importanza della Stechiometria
La stechiometria è la branca della chimica che si occupa delle relazioni quantitative tra i reagenti e i prodotti in una reazione chimica. Le equazioni bilanciate sono il fondamento di tutti i calcoli stechiometrici. Senza un'equazione bilanciata, non è possibile determinare le quantità precise di reagenti necessarie per ottenere una certa quantità di prodotto, o viceversa. Questo è cruciale in molte applicazioni, dall'industria chimica alla sintesi di farmaci in laboratorio.
Metodi per Bilanciare le Reazioni Chimiche
Esistono diversi metodi per bilanciare le reazioni chimiche, ma i due più comuni sono:
- Il metodo per tentativi (Trial and Error): Questo metodo è intuitivo e funziona bene per reazioni relativamente semplici. Si tratta di aggiustare i coefficienti stechiometrici (i numeri davanti alle formule chimiche) finché il numero di atomi di ciascun elemento non è lo stesso da entrambi i lati dell'equazione.
- Il metodo algebrico: Questo metodo è più sistematico e può essere utilizzato per reazioni più complesse. Si basa sulla creazione di un sistema di equazioni algebriche, una per ciascun elemento presente nella reazione, e sulla risoluzione del sistema per trovare i coefficienti stechiometrici.
Metodo per Tentativi: Un Esempio Pratico
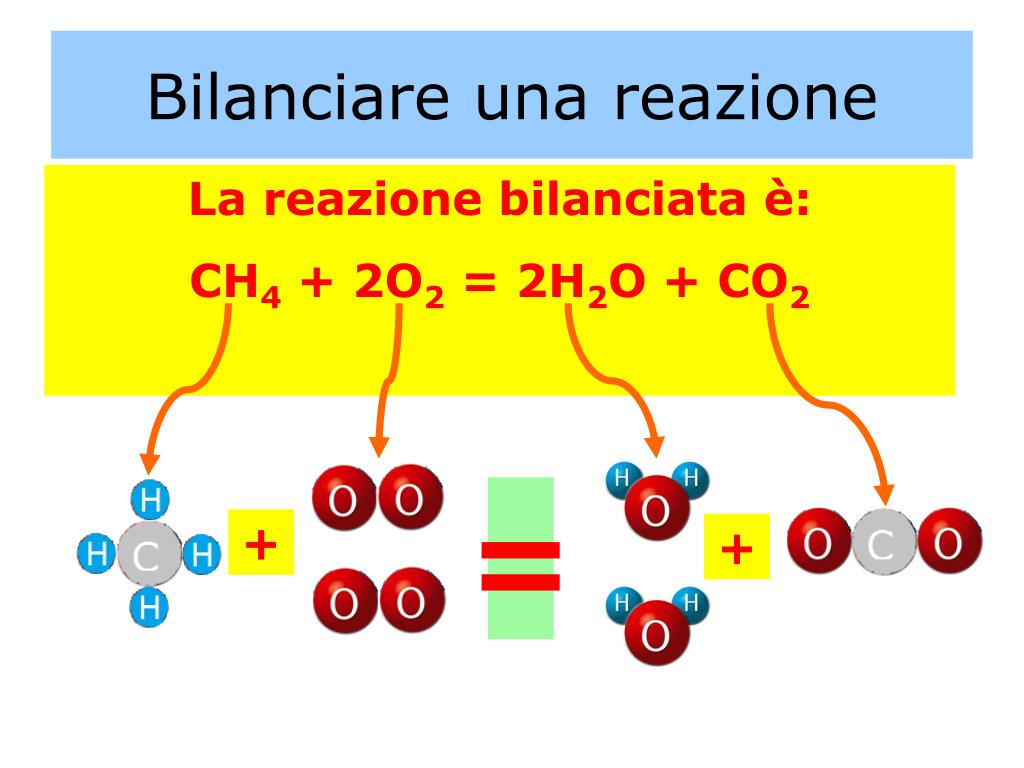
Consideriamo la reazione di combustione del metano (CH4) con l'ossigeno (O2) per produrre anidride carbonica (CO2) e acqua (H2O):
CH4 + O2 → CO2 + H2O (non bilanciata)
- Bilanciare il carbonio: C'è 1 atomo di carbonio sia nei reagenti che nei prodotti, quindi il carbonio è già bilanciato.
- Bilanciare l'idrogeno: Ci sono 4 atomi di idrogeno nei reagenti e 2 nei prodotti. Aggiungiamo un coefficiente di 2 davanti a H2O:
- Bilanciare l'ossigeno: Ci sono 2 atomi di ossigeno nei reagenti e 4 nei prodotti (2 da CO2 e 2 da 2H2O). Aggiungiamo un coefficiente di 2 davanti a O2:
CH4 + O2 → CO2 + 2H2O
CH4 + 2O2 → CO2 + 2H2O
Ora l'equazione è bilanciata. Ci sono 1 atomo di carbonio, 4 atomi di idrogeno e 4 atomi di ossigeno sia nei reagenti che nei prodotti.
Metodo Algebrico: Un Approccio Sistematico
Consideriamo una reazione più complessa, come la reazione tra il nitrato di argento (AgNO3) e il cloruro di sodio (NaCl) per produrre cloruro di argento (AgCl) e nitrato di sodio (NaNO3):
AgNO3 + NaCl → AgCl + NaNO3 (non bilanciata)
Assegniamo delle variabili (a, b, c, d) ai coefficienti stechiometrici:
aAgNO3 + bNaCl → cAgCl + dNaNO3
Ora scriviamo un'equazione per ciascun elemento:
- Argento (Ag): a = c
- Azoto (N): a = d
- Ossigeno (O): 3a = 3d
- Sodio (Na): b = d
- Cloro (Cl): b = c
Possiamo assumere che a = 1. Da questo, otteniamo:
- a = 1
- c = 1
- d = 1
- b = 1
Quindi, l'equazione bilanciata è:
AgNO3 + NaCl → AgCl + NaNO3
In questo caso, l'equazione era già bilanciata! Questo metodo è particolarmente utile quando le reazioni sono più intricate e il metodo per tentativi diventa difficile da applicare.
Esercizi di Bilanciamento con Soluzioni
Ora mettiamo alla prova le tue conoscenze con alcuni esercizi di bilanciamento. Cerca di risolverli prima di guardare le soluzioni. Ricorda, la pratica è fondamentale per padroneggiare questa abilità.
Esercizio 1
Bilanciare la seguente equazione:
KClO3 → KCl + O2
Soluzione:2KClO3 → 2KCl + 3O2
Esercizio 2
Bilanciare la seguente equazione:
H2 + N2 → NH3
Soluzione:3H2 + N2 → 2NH3
Esercizio 3
Bilanciare la seguente equazione:
C2H6 + O2 → CO2 + H2O
Soluzione:2C2H6 + 7O2 → 4CO2 + 6H2O
Esercizio 4
Bilanciare la seguente equazione:
Fe + O2 → Fe2O3
Soluzione:4Fe + 3O2 → 2Fe2O3
Esercizio 5
Bilanciare la seguente equazione:
NaOH + H2SO4 → Na2SO4 + H2O
Soluzione:2NaOH + H2SO4 → Na2SO4 + 2H2O
Esercizio 6
Bilanciare la seguente equazione:
Cu + HNO3 → Cu(NO3)2 + NO2 + H2O
Soluzione:Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
Esercizio 7
Bilanciare la seguente equazione:
KMnO4 + HCl → KCl + MnCl2 + H2O + Cl2
Soluzione:2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 8H2O + 5Cl2
Esercizio 8
Bilanciare la seguente equazione:
Ca3(PO4)2 + SiO2 + C → CaSiO3 + P4 + CO
Soluzione:2Ca3(PO4)2 + 6SiO2 + 10C → 6CaSiO3 + P4 + 10CO
Esercizio 9
Bilanciare la seguente equazione:
NH3 + O2 → NO + H2O
Soluzione:4NH3 + 5O2 → 4NO + 6H2O
Esercizio 10
Bilanciare la seguente equazione:
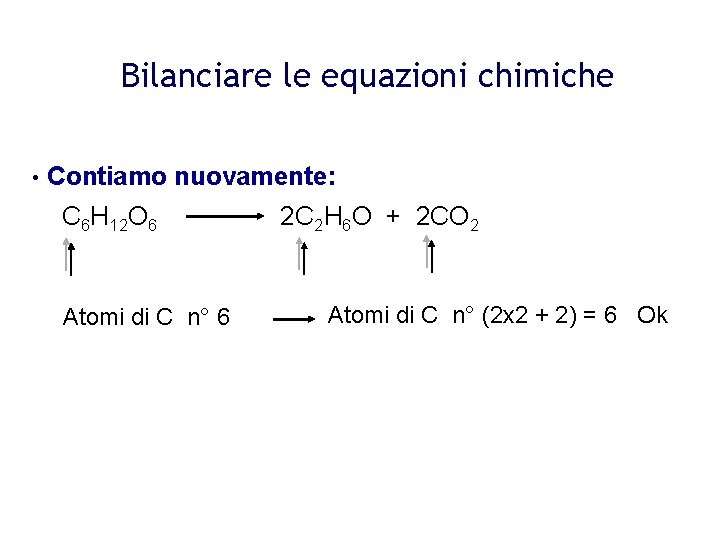
C6H12O6 → C2H5OH + CO2
Soluzione:C6H12O6 → 2C2H5OH + 2CO2
Applicazioni Reali del Bilanciamento delle Reazioni Chimiche
Il bilanciamento delle reazioni chimiche non è solo un esercizio teorico; ha importanti applicazioni pratiche in molti campi.
- Industria Chimica: Nella produzione di sostanze chimiche su larga scala, è fondamentale conoscere i rapporti stechiometrici precisi per ottimizzare la resa e ridurre al minimo gli sprechi.
- Medicina: Nella sintesi di farmaci, il bilanciamento delle reazioni è essenziale per garantire la purezza e l'efficacia del prodotto finale.
- Ingegneria Ambientale: Nel trattamento delle acque reflue e nella depurazione dell'aria, il bilanciamento delle reazioni chimiche aiuta a progettare processi efficienti per la rimozione degli inquinanti.
- Scienza dei Materiali: Nella sintesi di nuovi materiali, il bilanciamento delle reazioni è cruciale per controllare la composizione e le proprietà del materiale.
Ad esempio, nella produzione di ammoniaca (NH3) attraverso il processo Haber-Bosch, la reazione tra azoto (N2) e idrogeno (H2) deve essere attentamente bilanciata per massimizzare la conversione dei reagenti in prodotto:
N2 + 3H2 ⇌ 2NH3
Un controllo preciso dei rapporti stechiometrici e delle condizioni di reazione (temperatura, pressione, catalizzatore) è fondamentale per ottenere una resa elevata e un processo economicamente vantaggioso.
Conclusione e Invito all'Azione
Il bilanciamento delle reazioni chimiche è un'abilità essenziale per chiunque studi o lavori nel campo della chimica. Non è solo un esercizio meccanico, ma una comprensione profonda della legge di conservazione della massa e dei rapporti stechiometrici. Con la pratica, diventerai sempre più abile nel bilanciare equazioni chimiche di ogni complessità.
Non smettere di esercitarti! Cerca altri esercizi online, consulta il tuo libro di testo e chiedi aiuto al tuo insegnante o ai tuoi compagni di studio. Più pratichi, più diventerai sicuro e competente.
Speriamo che questo articolo ti sia stato utile. Buon bilanciamento!