Numero Massimo Di Elettroni In Un Orbitale

Comprendere la struttura atomica è fondamentale per la chimica e la fisica. Uno degli aspetti chiave di questa struttura è la distribuzione degli elettroni attorno al nucleo. In particolare, è cruciale capire quanti elettroni possono occupare un orbitale. Questo articolo esplorerà il numero massimo di elettroni in un orbitale e i principi che governano questa limitazione.
Principi Fondamentali della Struttura Atomica
Per comprendere il numero massimo di elettroni in un orbitale, dobbiamo prima ripassare alcuni concetti fondamentali della struttura atomica.
Numeri Quantici
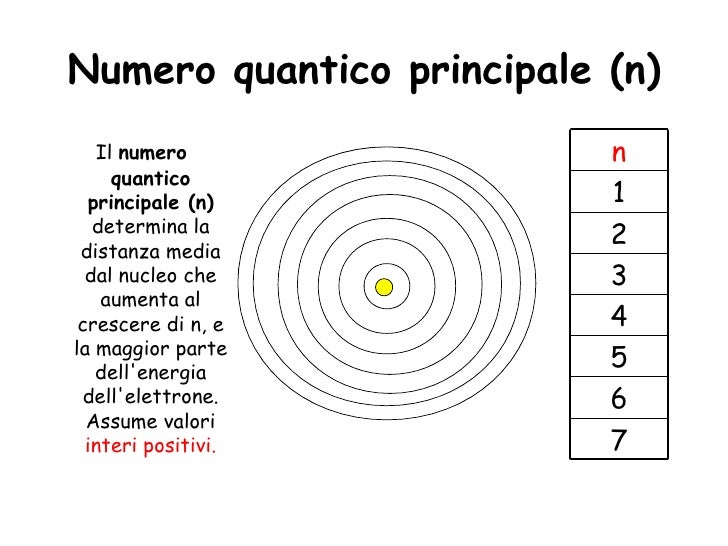
Gli elettroni in un atomo sono descritti da un insieme di quattro numeri quantici: il numero quantico principale (n), il numero quantico del momento angolare o azimutale (l), il numero quantico magnetico (ml), e il numero quantico di spin (ms). Ciascuno di questi numeri fornisce informazioni specifiche sull'elettrone:
- n (numero quantico principale): Definisce il livello energetico principale dell'elettrone (n = 1, 2, 3...). Maggiore è n, maggiore è l'energia e la distanza media dell'elettrone dal nucleo.
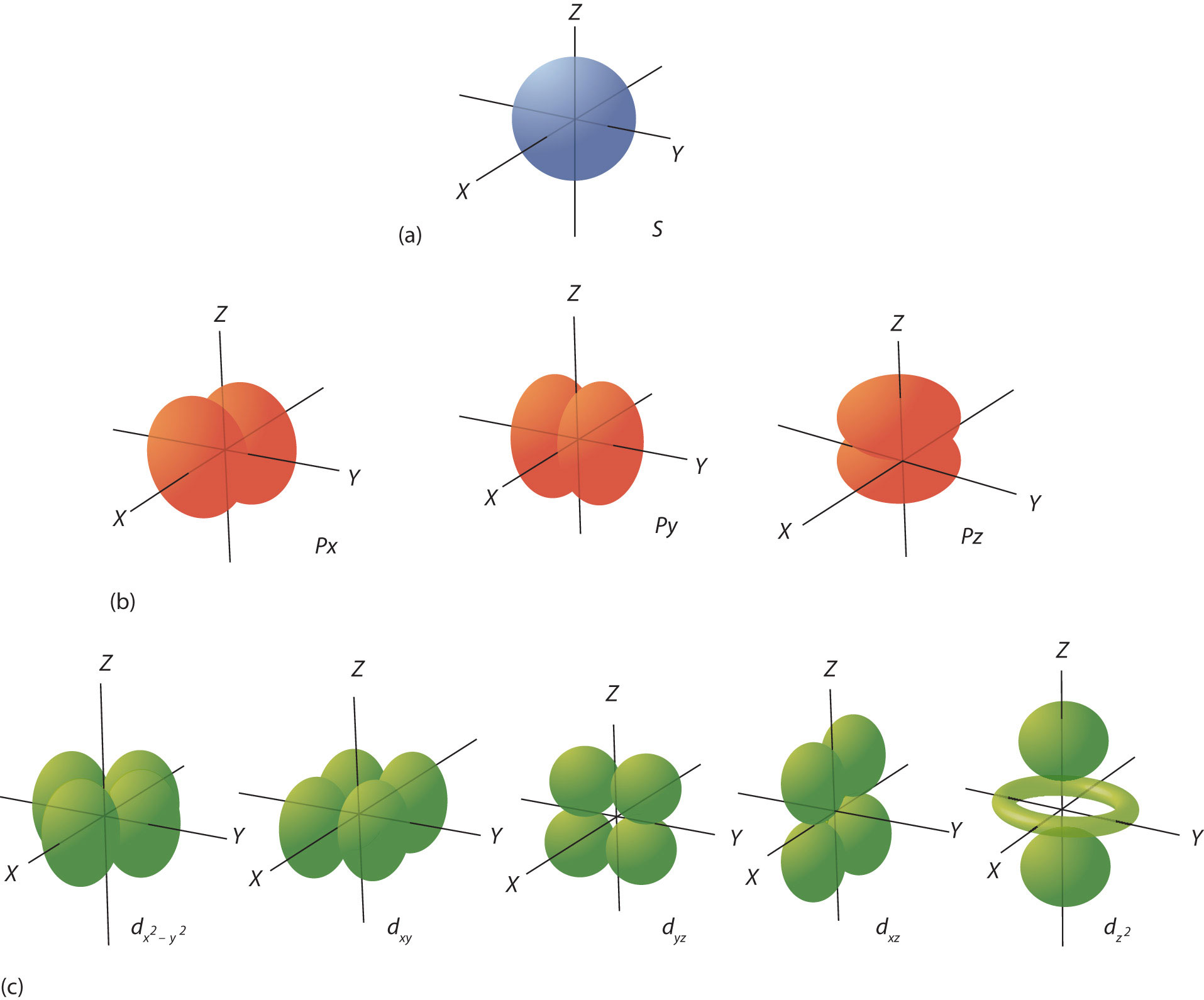
- l (numero quantico azimutale): Determina la forma dell'orbitale e ha valori compresi tra 0 e n-1. l = 0 corrisponde a un orbitale s (sferico), l = 1 a un orbitale p (a forma di dumbbell), l = 2 a un orbitale d, e l = 3 a un orbitale f.
- ml (numero quantico magnetico): Descrive l'orientamento spaziale dell'orbitale e assume valori interi compresi tra -l e +l, incluso lo 0. Ad esempio, per l = 1 (orbitale p), ml può essere -1, 0, o +1, corrispondenti ai tre orbitali p orientati lungo gli assi x, y e z.
- ms (numero quantico di spin): Rappresenta il momento angolare di spin intrinseco dell'elettrone, che è quantizzato e può avere solo due valori: +1/2 (spin up) o -1/2 (spin down).
Orbitali Atomici
Un orbitale atomico è una regione di spazio attorno al nucleo dove è più probabile trovare un elettrone. Ogni orbitale è definito da un insieme specifico di numeri quantici (n, l, ml). Ad esempio, un orbitale 1s è definito da n=1, l=0, ml=0. Poiché l'orbitale s è sferico e simmetrico, ha un solo orientamento spaziale.
Gli orbitali p, d, e f hanno forme più complesse e orientazioni spaziali multiple, come determinato dal numero quantico magnetico (ml). Ci sono tre orbitali p (px, py, pz), cinque orbitali d, e sette orbitali f per ogni livello energetico principale (n) in cui sono definiti.
Il Principio di Esclusione di Pauli
Il principio di esclusione di Pauli è cruciale per determinare il numero massimo di elettroni in un orbitale. Questo principio afferma che due elettroni in un atomo non possono avere lo stesso identico insieme di quattro numeri quantici (n, l, ml, ms). In altre parole, ogni elettrone deve avere una combinazione unica di questi numeri.
Questo principio ha conseguenze profonde sulla struttura elettronica degli atomi e sulla tavola periodica. Impone limiti rigorosi su quanti elettroni possono occupare un determinato orbitale e un determinato livello energetico.
Numero Massimo di Elettroni in un Orbitale
Consideriamo un orbitale specifico, definito da un insieme specifico di numeri quantici (n, l, ml). Ad esempio, prendiamo l'orbitale 2px (n=2, l=1, ml=+1). Secondo il principio di esclusione di Pauli, quanti elettroni possono occupare questo orbitale?
Poiché n, l, e ml sono fissati per questo orbitale specifico, l'unico numero quantico che può variare è ms, lo spin. Un elettrone può avere ms = +1/2 (spin up) oppure ms = -1/2 (spin down). Pertanto, un orbitale specifico può contenere al massimo due elettroni, uno con spin up e uno con spin down.
Questo vale per ogni orbitale, indipendentemente dalla sua forma o orientamento. Che si tratti di un orbitale s, p, d o f, il numero massimo di elettroni che può ospitare è sempre due.
Conseguenze per la Configurazione Elettronica
La limitazione a due elettroni per orbitale ha un impatto significativo sulla configurazione elettronica degli atomi. La configurazione elettronica descrive come gli elettroni sono distribuiti tra i diversi orbitali e livelli energetici in un atomo.
Ecco come la capacità di due elettroni per orbitale influenza il riempimento degli orbitali:
- Orbitali s: Ogni livello energetico principale ha un solo orbitale s (n=1 ha 1s, n=2 ha 2s, ecc.). Poiché un orbitale s può contenere al massimo due elettroni, ogni livello energetico principale può avere al massimo due elettroni negli orbitali s.
- Orbitali p: A partire dal livello energetico n=2, sono presenti tre orbitali p (px, py, pz). Ognuno di questi può contenere due elettroni, per un totale di 6 elettroni in tutti gli orbitali p di un dato livello energetico principale.
- Orbitali d: A partire dal livello energetico n=3, sono presenti cinque orbitali d. Ognuno di questi può contenere due elettroni, per un totale di 10 elettroni in tutti gli orbitali d di un dato livello energetico principale.
- Orbitali f: A partire dal livello energetico n=4, sono presenti sette orbitali f. Ognuno di questi può contenere due elettroni, per un totale di 14 elettroni in tutti gli orbitali f di un dato livello energetico principale.
Queste capacità limitate degli orbitali dettano la struttura della tavola periodica e le proprietà chimiche degli elementi. Ad esempio, la prima riga della tavola periodica (idrogeno ed elio) corrisponde al riempimento dell'orbitale 1s. La seconda riga (litio fino a neon) corrisponde al riempimento degli orbitali 2s e 2p.
Esempi Pratici e Dati Reali
Consideriamo alcuni esempi specifici:
* Elio (He): L'elio ha due elettroni. Entrambi occupano l'orbitale 1s, con spin opposti (1s2). * Litio (Li): Il litio ha tre elettroni. I primi due occupano l'orbitale 1s (1s2), e il terzo elettrone occupa l'orbitale 2s (2s1). * Ossigeno (O): L'ossigeno ha otto elettroni. La sua configurazione elettronica è 1s2 2s2 2p4. Questo significa che l'orbitale 1s è completamente pieno (due elettroni), l'orbitale 2s è completamente pieno (due elettroni), e gli orbitali 2p sono parzialmente pieni (quattro elettroni). Poiché ci sono tre orbitali 2p, due di essi saranno pieni (due elettroni ciascuno) e uno sarà parzialmente pieno (solo due elettroni, violando la regola di Hund, che favorisce la massima molteplicità di spin).Le configurazioni elettroniche possono essere determinate sperimentalmente attraverso la spettroscopia. Tecniche come la spettroscopia fotoelettronica (PES) misurano le energie di ionizzazione degli elettroni in un atomo, fornendo informazioni dirette sui livelli energetici e le configurazioni elettroniche.
Applicazioni e Importanza
La comprensione del numero massimo di elettroni in un orbitale è fondamentale per:
- Prevedere il comportamento chimico: La configurazione elettronica di un atomo determina la sua reattività chimica. Gli atomi tendono a reagire per raggiungere una configurazione elettronica stabile, di solito riempiendo i loro gusci di valenza (il guscio più esterno).
- Spiegare le proprietà dei materiali: Le proprietà dei materiali, come la conducibilità elettrica e termica, sono influenzate dalla struttura elettronica. Ad esempio, i metalli hanno una banda di valenza parzialmente piena, il che consente agli elettroni di muoversi liberamente e condurre elettricità.
- Sviluppare nuove tecnologie: La progettazione di nuovi materiali e dispositivi, come i semiconduttori e le celle solari, richiede una conoscenza approfondita della struttura elettronica degli atomi e delle molecole.
Conclusione
Il principio di esclusione di Pauli limita il numero massimo di elettroni in un orbitale a due. Questa limitazione ha implicazioni profonde per la struttura atomica, la configurazione elettronica, e le proprietà chimiche degli elementi. Comprendere questo principio è essenziale per studiare la chimica, la fisica e la scienza dei materiali.
Approfondire la conoscenza della struttura atomica è un passo cruciale per chiunque si avvicini alle scienze naturali. Incoraggio tutti a continuare ad esplorare questi affascinanti argomenti e a scoprire le meraviglie del mondo che ci circonda. Approfondite le vostre conoscenze con risorse online, libri di testo e chiedendo ai vostri insegnanti. Il mondo della chimica e della fisica è ricco di scoperte che aspettano solo di essere fatte!