Le Forze Di Van Der Waals

Capita a tutti di chiedersi, di tanto in tanto, perché certe cose si attaccano e altre no. Perché l'acqua si aggrappa al vetro formando una goccia, o perché un geco riesce a passeggiare tranquillamente su una parete liscia. Dietro a questi fenomeni apparentemente semplici si nasconde una forza fondamentale, spesso sottovalutata, ma onnipresente nel mondo che ci circonda: le Forze di Van der Waals.
Queste forze, pur essendo relativamente deboli rispetto ai legami chimici tradizionali, giocano un ruolo cruciale in una miriade di processi, dalla struttura delle proteine alla coesione dei liquidi, fino all'adesione di un adesivo. Ignorarle significherebbe non comprendere appieno la natura della materia e le sue interazioni.
Cercheremo quindi di addentrarci in questo affascinante mondo, svelando i misteri delle Forze di Van der Waals e mostrando come, anche se invisibili, influenzano costantemente la nostra vita quotidiana.
Cosa sono le Forze di Van der Waals?
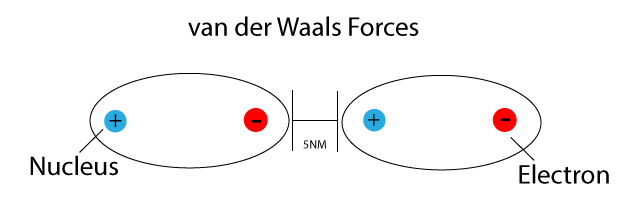
Le Forze di Van der Waals sono forze intermolecolari attrattive o repulsive tra molecole neutre (cioè, molecole che non hanno una carica elettrica netta). Sono classificate come forze deboli a corto raggio, il che significa che la loro influenza diminuisce rapidamente con l'aumentare della distanza tra le molecole.
Esistono tre tipi principali di Forze di Van der Waals:
- Forze di Keesom (dipolo-dipolo): Si verificano tra molecole polari, ovvero molecole che hanno una distribuzione non uniforme della carica elettrica, creando un polo positivo e uno negativo. L'estremità positiva di una molecola attira l'estremità negativa di un'altra. Pensiamo all'acqua (H₂O): l'ossigeno è più elettronegativo dell'idrogeno, quindi attrae gli elettroni, creando una parziale carica negativa sull'ossigeno e una parziale carica positiva sugli idrogeni. Queste cariche parziali si attraggono tra molecole d'acqua vicine.
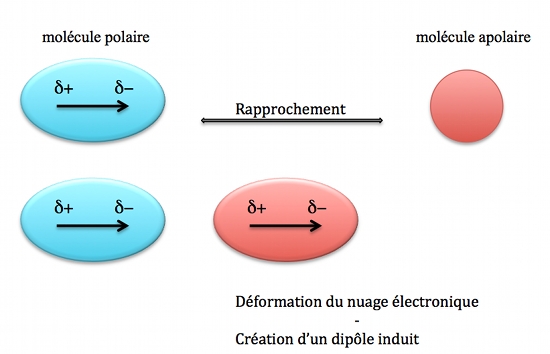
- Forze di Debye (dipolo-indotto dipolo): Si verificano tra una molecola polare e una molecola non polare. La molecola polare induce una polarizzazione temporanea nella molecola non polare, creando un dipolo indotto. Immaginate di avvicinare un palloncino carico (polare) a piccoli pezzi di carta (non polari). Il palloncino deforma temporaneamente la distribuzione di carica nei pezzi di carta, creando un dipolo indotto e facendoli aderire.
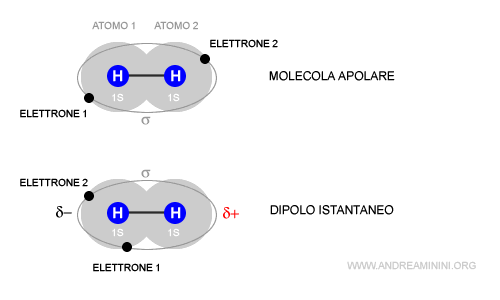
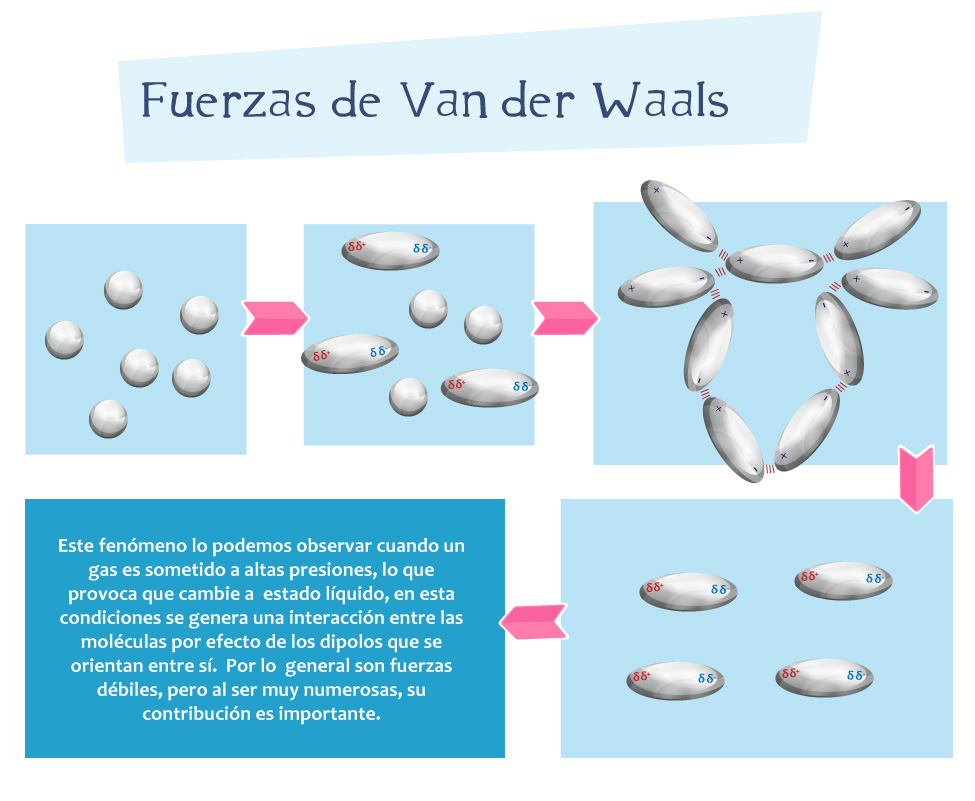
- Forze di London (forze di dispersione): Si verificano tra tutte le molecole, sia polari che non polari. Sono dovute a fluttuazioni temporanee della distribuzione degli elettroni all'interno di una molecola, creando dipoli istantanei. Anche se una molecola è mediamente non polare, in un dato istante la distribuzione degli elettroni può essere leggermente asimmetrica, creando un dipolo temporaneo che induce un dipolo in una molecola vicina. Queste sono le forze responsabili della condensazione di gas nobili come l'elio e il neon a bassissime temperature.
È importante sottolineare che le Forze di London sono sempre presenti tra tutte le molecole, anche quelle polari. In molecole polari, le Forze di Keesom e Debye contribuiscono in modo significativo, ma le Forze di London rimangono fondamentali.
Un'analogia per capire meglio:
Immaginate una pista da ballo con persone in piedi. Le Forze di Keesom sono come due persone che si piacciono e si avvicinano intenzionalmente. Le Forze di Debye sono come una persona che convince un'altra a ballare per un breve periodo. Le Forze di London sono come tutti gli altri, che si muovono casualmente e a volte si scontrano o si sfiorano. Anche se alcune persone si avvicinano intenzionalmente, tutti sperimentano movimenti e interazioni casuali.
L'impatto reale delle Forze di Van der Waals
Le Forze di Van der Waals sono ovunque e influenzano innumerevoli aspetti della nostra vita. Ecco alcuni esempi:
- Adesione: Sono fondamentali per il funzionamento di adesivi e nastri adesivi. Le molecole dell'adesivo interagiscono con la superficie a cui viene applicato tramite le Forze di Van der Waals, creando un legame che tiene insieme i materiali.
- Coesione: Contribuiscono alla coesione dei liquidi, ovvero alla tendenza delle molecole di un liquido a rimanere unite. Questo spiega perché l'acqua forma gocce e ha una tensione superficiale.
- Punto di ebollizione e fusione: Influenzano i punti di ebollizione e fusione delle sostanze. Sostanze con forze di Van der Waals più forti richiedono più energia per essere trasformate in gas o liquidi.
- Struttura delle proteine: Sono essenziali per il corretto ripiegamento e la stabilità delle proteine. Le interazioni tra diverse parti della molecola proteica, mediate dalle Forze di Van der Waals, determinano la sua forma tridimensionale e la sua funzione biologica.
- Interazioni farmaco-recettore: Svolgono un ruolo importante nell'interazione tra farmaci e i loro recettori nel corpo. L'affinità di un farmaco per il suo recettore dipende in parte dalle Forze di Van der Waals tra le due molecole.
- Adesione dei gechi: I gechi possono arrampicarsi su superfici verticali grazie a milioni di setole microscopiche sulle loro zampe. Queste setole si adattano alla superficie e interagiscono con essa tramite le Forze di Van der Waals, creando un'adesione sufficiente per sostenere il peso del geco.
Questi sono solo alcuni esempi, ma dimostrano come le Forze di Van der Waals siano fondamentali per comprendere il comportamento della materia a livello molecolare e come influenzino una vasta gamma di fenomeni che ci circondano.
Affrontare le opinioni contrarie
Alcuni potrebbero sostenere che, data la loro debolezza, le Forze di Van der Waals sono irrilevanti rispetto ad altre forze, come i legami ionici o covalenti. È vero che i legami chimici sono molto più forti, ma le Forze di Van der Waals agiscono su grandi distanze e collettivamente possono avere un impatto significativo. Ad esempio, anche se ogni singola forza di Van der Waals tra un geco e una parete è debole, il gran numero di setole che interagiscono contemporaneamente crea un'adesione sufficiente. Inoltre, in molti sistemi biologici e chimici, le interazioni sono determinate da un equilibrio delicato tra diverse forze, e le Forze di Van der Waals possono essere il fattore decisivo.
Un'altra critica potrebbe riguardare la difficoltà di misurare direttamente le Forze di Van der Waals. Effettivamente, la loro debolezza e la loro dipendenza dalla distanza rendono la misurazione complessa. Tuttavia, esistono tecniche sperimentali, come la microscopia a forza atomica (AFM), che permettono di studiare queste forze a livello nanoscopico. Inoltre, la modellizzazione computazionale e la chimica teorica forniscono strumenti potenti per calcolare e comprendere il contributo delle Forze di Van der Waals a diverse proprietà dei materiali.
Riconoscere queste critiche ci permette di apprezzare la complessità del tema e di comprendere che la nostra conoscenza delle Forze di Van der Waals è in continua evoluzione.
Soluzioni e applicazioni future
La comprensione delle Forze di Van der Waals non è solo un esercizio teorico, ma ha importanti implicazioni pratiche. Ecco alcune aree in cui la ricerca e l'applicazione di queste conoscenze possono portare a progressi significativi:
- Sviluppo di nuovi adesivi: Comprendere i meccanismi di adesione a livello molecolare può portare alla creazione di adesivi più forti, più resistenti e più ecologici.
- Progettazione di farmaci: Ottimizzare le interazioni farmaco-recettore tramite le Forze di Van der Waals può migliorare l'efficacia dei farmaci e ridurre gli effetti collaterali.
- Scienza dei materiali: Manipolare le Forze di Van der Waals tra i materiali può portare alla creazione di materiali con proprietà nuove e inaspettate, come materiali superidrofobici o con una maggiore resistenza meccanica.
- Nanotecnologie: Le Forze di Van der Waals sono fondamentali per l'assemblaggio di nanostrutture e per la creazione di dispositivi nanotecnologici.
Investire nella ricerca sulle Forze di Van der Waals significa investire nel futuro della scienza e della tecnologia, aprendo nuove frontiere in diversi campi.
Un'ultima riflessione
Le Forze di Van der Waals sono un esempio di come le forze più piccole e apparentemente insignificanti possano avere un impatto enorme sul mondo che ci circonda. Ci ricordano che la natura è piena di sorprese e che anche i fenomeni più semplici possono nascondere una complessità affascinante.
Avendo esplorato le Forze di Van der Waals, vi invito a riflettere: come cambierà la vostra percezione del mondo ora che sapete che queste forze invisibili influenzano costantemente la vostra vita? Quali nuove domande vi suscita questa conoscenza?