La Geometria Della Molecola Di Diossido Di Carbonio è
La geometria molecolare è un concetto fondamentale in chimica, che descrive la disposizione tridimensionale degli atomi che compongono una molecola. Questa disposizione influenza in modo significativo le proprietà fisiche e chimiche della molecola stessa, determinandone la reattività, la polarità e le interazioni intermolecolari. In questo articolo, esploreremo in dettaglio la geometria della molecola di diossido di carbonio (CO2), un composto onnipresente nell'atmosfera e cruciale per numerosi processi biologici e industriali.
La Struttura di Lewis del Diossido di Carbonio
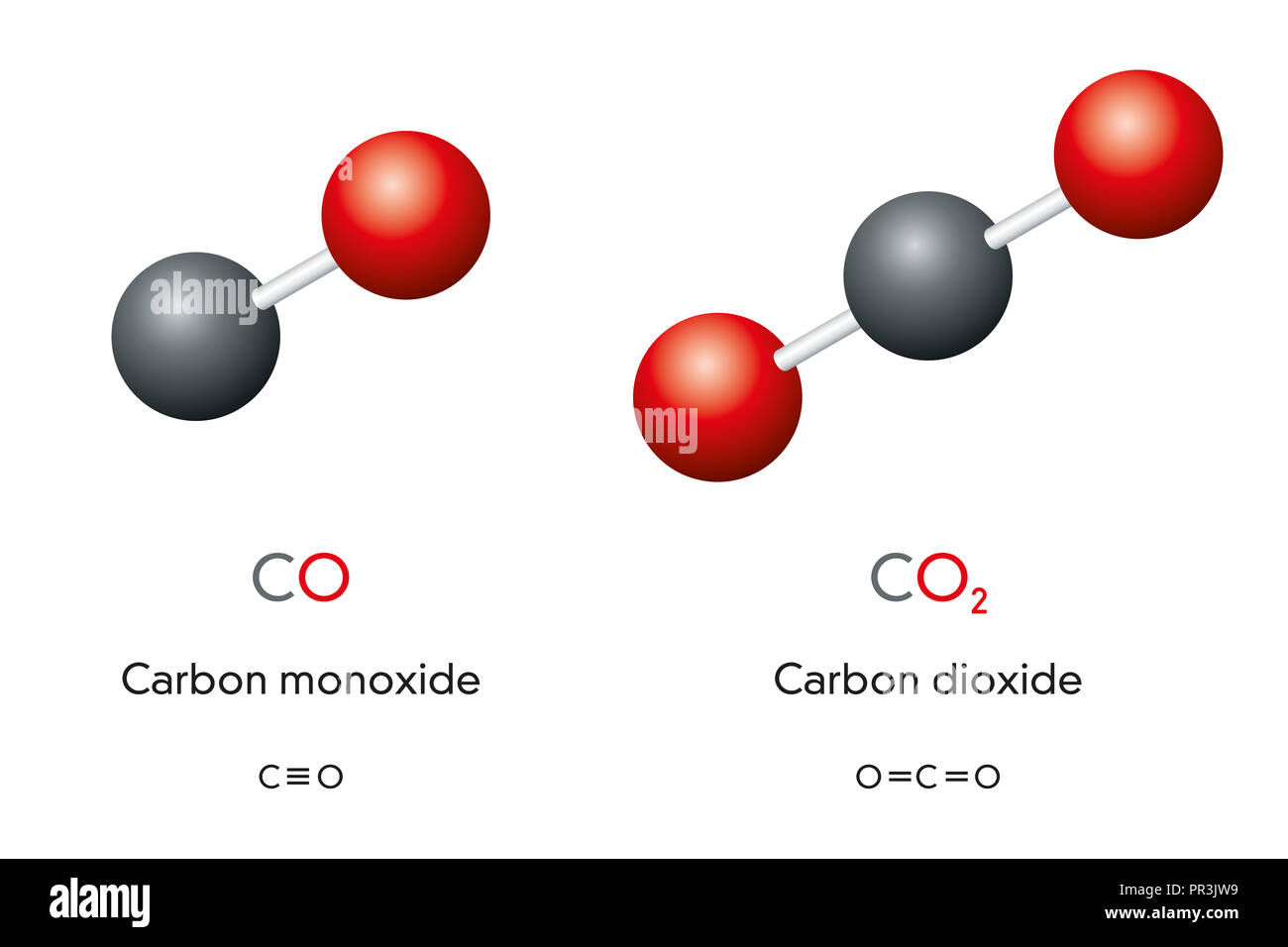
Prima di analizzare la geometria molecolare, è essenziale comprendere la struttura di Lewis del CO2. La struttura di Lewis rappresenta la connettività degli atomi e la distribuzione degli elettroni di valenza nella molecola. Nel caso del CO2, l'atomo di carbonio centrale è legato a due atomi di ossigeno tramite doppi legami. Ogni atomo di ossigeno possiede anche due coppie di elettroni non condivise (lone pairs). La formula chimica O=C=O riflette questa disposizione.
Questa particolare struttura è cruciale perché l'atomo di carbonio non possiede coppie di elettroni non condivise attorno a sé. Questo fatto, come vedremo, è il fattore determinante della geometria molecolare.
Teoria VSEPR e la Geometria Lineare
Cos'è la Teoria VSEPR?
La geometria molecolare del CO2 può essere accuratamente prevista utilizzando la teoria VSEPR (Valence Shell Electron Pair Repulsion), ovvero la repulsione delle coppie di elettroni del guscio di valenza. Questa teoria si basa sull'idea che le coppie di elettroni, sia quelle condivise (legami) che quelle non condivise (lone pairs), si respingono a vicenda e tendono a disporsi nello spazio in modo da minimizzare questa repulsione. In altre parole, gli elettroni cercano di stare il più lontano possibile l'uno dall'altro.
Applicazione della Teoria VSEPR al CO2
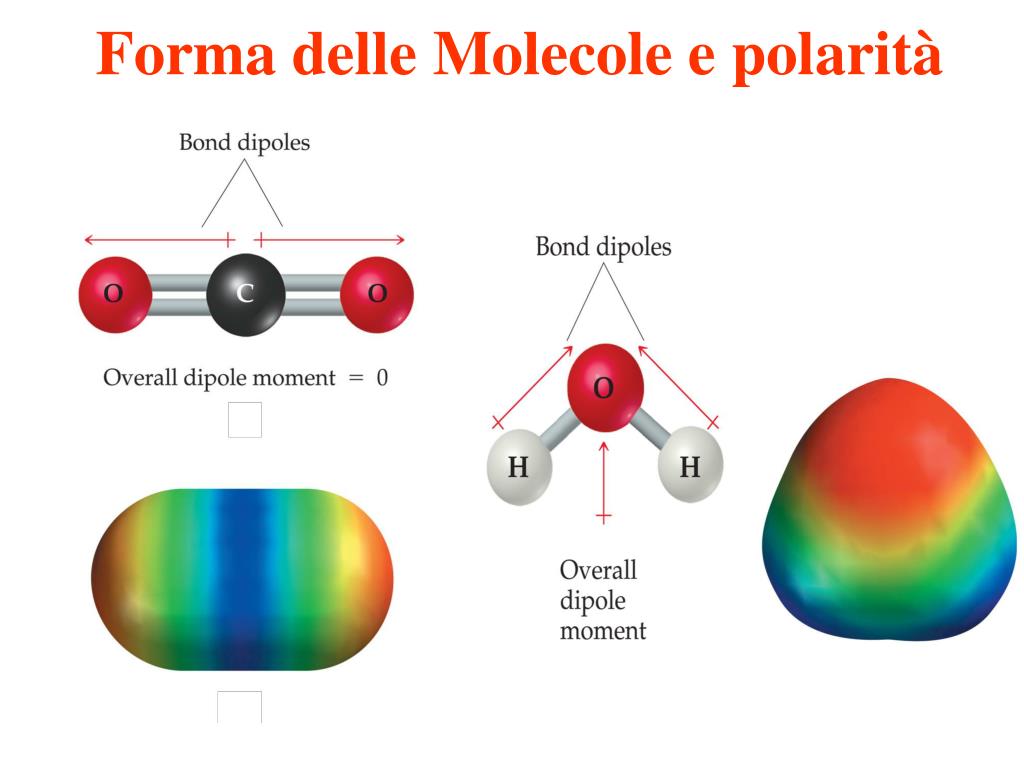
Nel caso del CO2, l'atomo di carbonio centrale è circondato da due gruppi di elettroni, ciascuno derivante da un doppio legame con un atomo di ossigeno. Poiché non ci sono coppie di elettroni non condivise sull'atomo di carbonio, i due gruppi di elettroni del legame si disporranno in modo da massimizzare la distanza tra loro. La disposizione che massimizza la distanza è una geometria lineare. Questo significa che l'angolo tra i due legami O=C=O è di 180 gradi.
Pertanto, la geometria molecolare del diossido di carbonio è lineare. Questo è un punto fondamentale. Se ci fossero coppie di elettroni non condivise sull'atomo di carbonio, la geometria sarebbe differente (es. angolata).
Polarità dei Legami e Polarità Molecolare
Sebbene i legami C=O siano polari (l'ossigeno è più elettronegativo del carbonio e attira quindi gli elettroni di legame), la molecola di CO2 nel suo complesso è non polare. Questo è un esempio chiave di come la geometria molecolare influenzi la polarità complessiva di una molecola.
La polarità di un legame è una misura della disuguale distribuzione degli elettroni tra due atomi legati. A causa della maggiore elettronegatività dell'ossigeno rispetto al carbonio, i legami C=O sono polari, con una parziale carica negativa (δ-) sull'ossigeno e una parziale carica positiva (δ+) sul carbonio. Tuttavia, poiché la molecola è lineare e i due legami C=O sono orientati in direzioni opposte, i loro momenti dipolari (vettori che rappresentano la polarità del legame) si annullano a vicenda. Il momento dipolare risultante della molecola è quindi zero, rendendola non polare.
Implicazioni della Geometria Lineare e Non Polarità del CO2
Interazioni Intermolecolari
La non polarità del CO2 influisce sulle sue interazioni intermolecolari. Poiché il CO2 è non polare, le uniche forze intermolecolari significative presenti sono le forze di London, che sono deboli. Questo contribuisce al fatto che il CO2 sia un gas a temperatura ambiente. Molecole polari avrebbero forze intermolecolari più forti, aumentando il punto di ebollizione.
Solubilità
La solubilità del CO2 in acqua è relativamente bassa, sempre a causa della sua non polarità. L'acqua è una molecola polare e tende a sciogliere bene altre molecole polari. Tuttavia, il CO2 si scioglie in acqua in una certa misura, formando acido carbonico (H2CO3) in un processo di equilibrio. Questa reazione è importante per regolare il pH degli oceani e influenza la quantità di CO2 presente nell'atmosfera.
Assorbimento Infrarosso e Effetto Serra
Nonostante la sua non polarità, il CO2 è una molecola importante per l'assorbimento della radiazione infrarossa, contribuendo all'effetto serra. La geometria lineare della molecola permette specifici modi di vibrazione che assorbono le frequenze infrarosse emesse dalla superficie terrestre. Questo assorbimento intrappola il calore nell'atmosfera, contribuendo al riscaldamento globale.
L'assorbimento della radiazione infrarossa è dovuto ai cambiamenti nei momenti dipolari durante le vibrazioni molecolari. Anche se la molecola è non polare allo stato fondamentale, alcune vibrazioni possono indurre un momento dipolare temporaneo, permettendo l'assorbimento di energia infrarossa.
Esempi Reali e Dati
La geometria lineare del CO2 è stata confermata da numerosi studi sperimentali, tra cui la spettroscopia a raggi X, la diffrazione di elettroni e la spettroscopia rotazionale. Questi studi forniscono dati precisi sulla lunghezza dei legami C=O (circa 116 pm) e sull'angolo di legame O=C=O (180 gradi).
- Dati spettroscopici: Analisi degli spettri infrarossi e Raman confermano i modi vibrazionali tipici di una molecola lineare triatomica.
- Studi di diffrazione: Esperimenti di diffrazione a raggi X su CO2 solido dimostrano la disposizione lineare delle molecole.
- Modellistica computazionale: Calcoli teorici utilizzando metodi di chimica quantistica predicono con precisione la geometria lineare e le proprietà elettroniche del CO2.
Un esempio reale dell'importanza della geometria del CO2 è il suo ruolo nel processo di fotosintesi. Le piante assorbono CO2 dall'atmosfera e, utilizzando l'energia solare, lo convertono in glucosio e ossigeno. La geometria lineare del CO2 facilita la sua incorporazione nei processi biochimici della fotosintesi.
Conclusioni
In conclusione, la geometria molecolare del diossido di carbonio è lineare, determinata dall'assenza di coppie di elettroni non condivise sull'atomo di carbonio centrale e dalla repulsione delle coppie di elettroni dei legami C=O, come previsto dalla teoria VSEPR. Questa geometria ha implicazioni significative sulla polarità, sulle interazioni intermolecolari, sulla solubilità e sulla capacità di assorbire la radiazione infrarossa del CO2.
Comprendere la geometria molecolare del CO2 è fondamentale per comprendere il suo ruolo in numerosi processi chimici, biologici e ambientali. Incoraggio ulteriormente l'esplorazione di questo argomento attraverso la consultazione di libri di testo di chimica e articoli scientifici. Approfondire la conoscenza della struttura molecolare aiuta a comprendere meglio il mondo che ci circonda.