Esperimento Legge Di Lavoisier Aceto E Bicarbonato

Ciao a tutti! Avete mai pensato di essere degli scienziati nel vostro salotto? Oggi vi guiderò attraverso un esperimento semplicissimo, ma incredibilmente illuminante, che dimostra una delle leggi fondamentali della chimica: la Legge di Lavoisier, nota anche come Legge di Conservazione della Massa. Quest'esperimento è perfetto per studenti di tutte le età, appassionati di scienza e chiunque sia curioso di capire come funziona il mondo che ci circonda.
Cos'è la Legge di Lavoisier?
Prima di immergerci nell'esperimento, capiamo bene di cosa stiamo parlando. La Legge di Lavoisier, formulata dal chimico francese Antoine Lavoisier nel XVIII secolo, afferma che "nulla si crea, nulla si distrugge, tutto si trasforma". In parole povere, in una reazione chimica, la massa totale dei reagenti (le sostanze che reagiscono) è uguale alla massa totale dei prodotti (le sostanze che si formano). Sembra magia, vero? Ma è pura scienza!
Immaginate di avere un mucchio di mattoncini LEGO. Potete smontarli e rimontarli in una forma diversa, magari un castello invece di una macchina. Avete cambiato la forma, ma la quantità totale di mattoncini (la massa) è rimasta la stessa. La Legge di Lavoisier ci dice che la stessa cosa accade nelle reazioni chimiche: gli atomi si riorganizzano, ma non si creano né si distruggono.
Il Nostro Esperimento: Aceto e Bicarbonato
Ora passiamo alla parte divertente: l'esperimento! Utilizzeremo due ingredienti che probabilmente avete già in casa: aceto e bicarbonato di sodio. Questa reazione è un classico, ma ci permette di visualizzare la Legge di Lavoisier in azione, anche se con qualche piccola accortezza.
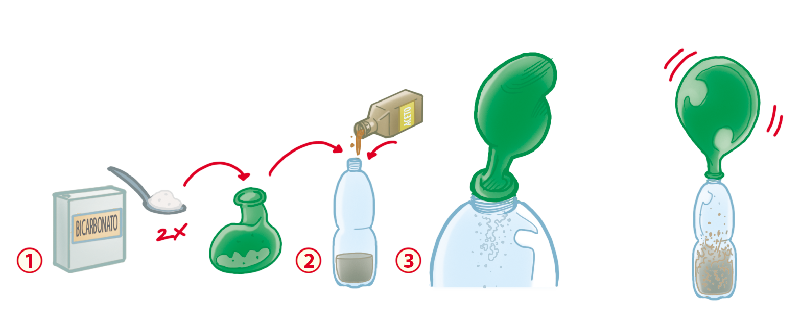
Materiali Necessari:
- Aceto bianco (circa 50 ml)
- Bicarbonato di sodio (circa 1 cucchiaino)
- Una bottiglia di plastica (ad esempio, una bottiglietta d'acqua)
- Un palloncino
- Una bilancia di precisione (essenziale per una buona dimostrazione)
- Un imbuto (facoltativo, ma utile per versare il bicarbonato nel palloncino)
Procedimento:
- Misuriamo la massa iniziale: Pesate la bottiglia vuota con il palloncino sgonfio. Annotate questo valore.
- Versiamo l'aceto nella bottiglia: Usando un imbuto (se necessario), versate circa 50 ml di aceto nella bottiglia.
- Prepariamo il bicarbonato: Riempite il palloncino con circa 1 cucchiaino di bicarbonato di sodio. Potrebbe essere utile usare un imbuto per questa operazione.
- Attacchiamo il palloncino alla bottiglia: Con attenzione, attaccate l'apertura del palloncino al collo della bottiglia, facendo attenzione a non far cadere il bicarbonato dentro. Assicuratevi che sia ben sigillato.
- Pesiamo di nuovo: Pesate la bottiglia con l'aceto e il palloncino pieno di bicarbonato prima di mescolare. Annotate questo valore. Questo è il peso totale dei reagenti.
- Diamo inizio alla reazione: Sollevate delicatamente il palloncino in modo che il bicarbonato cada nella bottiglia con l'aceto. Osservate cosa succede!
- Osserviamo la reazione: Vedrete il bicarbonato reagire con l'aceto, producendo bollicine e gonfiando il palloncino. Questo è anidride carbonica (CO2), un gas.
- Pesiamo il sistema finale: Una volta che la reazione si è conclusa (quando non si vedono più bollicine), pesate di nuovo la bottiglia con il palloncino gonfio. Annotate questo valore.
Cosa Dovremmo Osservare?
Idealmente, la massa misurata al punto 5 (prima della reazione) e al punto 8 (dopo la reazione) dovrebbero essere quasi identiche. Questo dimostrerebbe la Legge di Lavoisier: la massa totale del sistema (bottiglia, aceto, bicarbonato e palloncino) rimane costante durante la reazione chimica.
Perché "Quasi" Identiche?
Nella realtà, potreste notare una piccola differenza di massa. Questo può essere dovuto a diversi fattori:
- Perdita di gas: Il palloncino potrebbe non essere perfettamente sigillato, e una piccola quantità di anidride carbonica potrebbe sfuggire.
- Errori di misurazione: La bilancia potrebbe non essere precisissima, oppure potrebbero esserci piccoli errori nella misurazione dei volumi.
- Umidità: L'umidità nell'aria può influenzare leggermente il peso del sistema.
- Galleggiamento dell'aria: Il palloncino gonfiato con CO2 è leggermente più leggero dell'aria che sposta.
Anche se la massa potrebbe non essere perfettamente conservata nel nostro esperimento domestico, l'importante è che la differenza sia minima. Questo ci dà un'idea chiara di come funziona la Legge di Lavoisier.
Cosa Sta Succedendo a Livello Chimico?
La reazione che abbiamo osservato è una reazione acido-base tra l'aceto (acido acetico, CH3COOH) e il bicarbonato di sodio (NaHCO3). La reazione produce anidride carbonica (CO2), acqua (H2O) e acetato di sodio (CH3COONa). L'anidride carbonica è il gas che gonfia il palloncino.
La reazione chimica può essere scritta così:
CH3COOH (aceto) + NaHCO3 (bicarbonato) → CH3COONa (acetato di sodio) + H2O (acqua) + CO2 (anidride carbonica)
Anche se le sostanze cambiano e si trasformano, il numero di atomi di ogni elemento rimane lo stesso da entrambi i lati dell'equazione. Questo è un altro modo di vedere la Legge di Lavoisier in azione!
Come Rendere l'Esperimento Più Preciso
Se volete rendere l'esperimento più preciso, ecco alcuni consigli:
- Utilizzate una bilancia di precisione: Una bilancia con una precisione di almeno 0.01 grammi è ideale.
- Sigillate il sistema: Cercate di sigillare il sistema il più possibile per evitare la perdita di gas. Potreste usare un tappo con un foro per far passare il palloncino e sigillare il foro con della colla a caldo.
- Eseguite l'esperimento in un ambiente controllato: Evitate correnti d'aria e variazioni di temperatura.
- Ripetete l'esperimento: Eseguite l'esperimento più volte e calcolate la media dei risultati per ridurre l'errore sperimentale.
Perché è Importante la Legge di Lavoisier?
La Legge di Lavoisier è una delle pietre miliari della chimica moderna. Ha permesso agli scienziati di capire che le reazioni chimiche non sono eventi magici, ma processi prevedibili che seguono leggi precise. Questa legge è fondamentale per:
- Bilanciare le equazioni chimiche: Assicura che il numero di atomi di ogni elemento sia lo stesso da entrambi i lati dell'equazione.
- Calcolare le quantità di reagenti e prodotti: Permette di prevedere quanto prodotto si otterrà da una certa quantità di reagenti.
- Comprendere le reazioni chimiche: Fornisce una base per capire come avvengono le trasformazioni chimiche.
- Applicazioni pratiche: È utilizzata in moltissimi campi, dalla produzione di farmaci alla sintesi di nuovi materiali.
Conclusioni
Spero che questo esperimento vi sia piaciuto e vi abbia aiutato a capire meglio la Legge di Lavoisier. Ricordate, la scienza è ovunque intorno a noi, anche nella nostra cucina! Non abbiate paura di sperimentare, fare domande e mettervi alla prova. La chimica è un mondo affascinante, e questo è solo un piccolo assaggio.
Ora tocca a voi! Provate l'esperimento, osservate i risultati e condividete le vostre scoperte. La scienza è un'avventura che possiamo vivere tutti insieme. E ricordate, anche se qualcosa va storto, è sempre un'opportunità per imparare qualcosa di nuovo. Buon divertimento!