Dalla Struttura Atomica All Elettrochimica Soluzioni

Hai mai pensato a come una batteria, un oggetto così piccolo e comune, possa alimentare il tuo smartphone o un'auto elettrica? La risposta si trova nel mondo affascinante dell'elettrochimica, un campo che collega la struttura atomica della materia con le reazioni chimiche che generano elettricità e viceversa. Questo articolo esplorerà questo legame, dalla comprensione degli atomi fino alla creazione di soluzioni elettrochimiche innovative. È pensato per studenti di chimica, appassionati di scienza e chiunque voglia capire meglio il funzionamento delle tecnologie che ci circondano.
Dall'Atomo all'Ione: Le Fondamenta dell'Elettrochimica
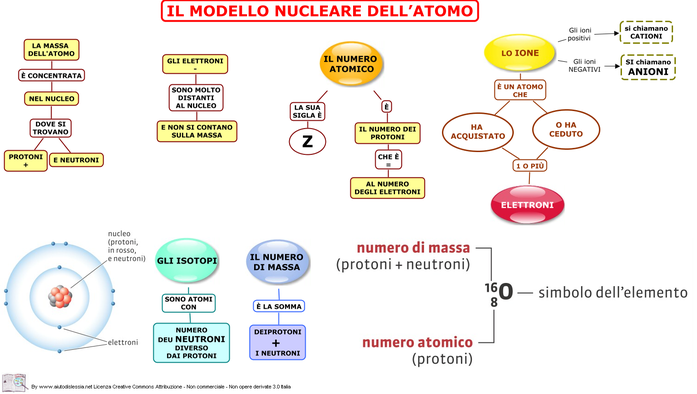
Per comprendere l'elettrochimica, dobbiamo prima ritornare alle basi: l'atomo. Ricorda che un atomo è composto da un nucleo contenente protoni (cariche positive) e neutroni (senza carica), circondato da elettroni (cariche negative) che orbitano attorno al nucleo in specifici livelli energetici. Questi elettroni sono cruciali per le reazioni elettrochimiche.
La Struttura Atomica e la Tavola Periodica
La tavola periodica organizza gli elementi in base al loro numero atomico (il numero di protoni) e alle loro proprietà chimiche. La posizione di un elemento nella tavola periodica ci dice molto sulla sua tendenza a guadagnare o perdere elettroni. Ad esempio:
- Gli elementi del gruppo 1 (metalli alcalini) tendono a perdere facilmente un elettrone per formare ioni con carica +1.
- Gli elementi del gruppo 17 (alogeni) tendono a guadagnare un elettrone per formare ioni con carica -1.
- I gas nobili (gruppo 18) sono inerti, ovvero hanno una configurazione elettronica stabile e non tendono a reagire.
Questi comportamenti sono determinati dalla tendenza degli atomi a raggiungere una configurazione elettronica stabile, simile a quella dei gas nobili. Questa "regola dell'ottetto" afferma che gli atomi tendono a combinarsi in modo da avere otto elettroni nel loro guscio di valenza (l'ultimo livello energetico).
Ioni: Atomi con Carica
Quando un atomo guadagna o perde elettroni, diventa uno ione. Gli ioni positivi, chiamati cationi, si formano quando un atomo perde elettroni. Gli ioni negativi, chiamati anioni, si formano quando un atomo guadagna elettroni. Ad esempio, il sodio (Na) tende a perdere un elettrone per formare l'ione sodio (Na+), mentre il cloro (Cl) tende a guadagnare un elettrone per formare l'ione cloruro (Cl-).
La formazione di ioni è alla base della conduzione elettrica nelle soluzioni elettrolitiche, che vedremo più avanti.
Reazioni Redox: Il Cuore dell'Elettrochimica
Le reazioni elettrochimiche sono reazioni di ossidoriduzione (redox), in cui gli elettroni vengono trasferiti da una specie chimica all'altra. Queste reazioni coinvolgono sempre due processi distinti:
- Ossidazione: Perdita di elettroni. La specie che perde elettroni viene ossidata.
- Riduzione: Guadagno di elettroni. La specie che guadagna elettroni viene ridotta.
È fondamentale ricordare che l'ossidazione e la riduzione avvengono sempre contemporaneamente. Non può esserci ossidazione senza riduzione e viceversa. La specie che causa l'ossidazione di un'altra specie è chiamata agente ossidante (e viene ridotta nel processo), mentre la specie che causa la riduzione di un'altra specie è chiamata agente riducente (e viene ossidata nel processo).
Esempi di Reazioni Redox
Consideriamo la reazione tra lo zinco metallico (Zn) e lo ione rame (II) (Cu2+):
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
In questa reazione:
- Lo zinco metallico (Zn) viene ossidato a ione zinco (Zn2+), perdendo due elettroni. Zn → Zn2+ + 2e-
- Lo ione rame (II) (Cu2+) viene ridotto a rame metallico (Cu), guadagnando due elettroni. Cu2+ + 2e- → Cu
Lo zinco è l'agente riducente, mentre lo ione rame (II) è l'agente ossidante.
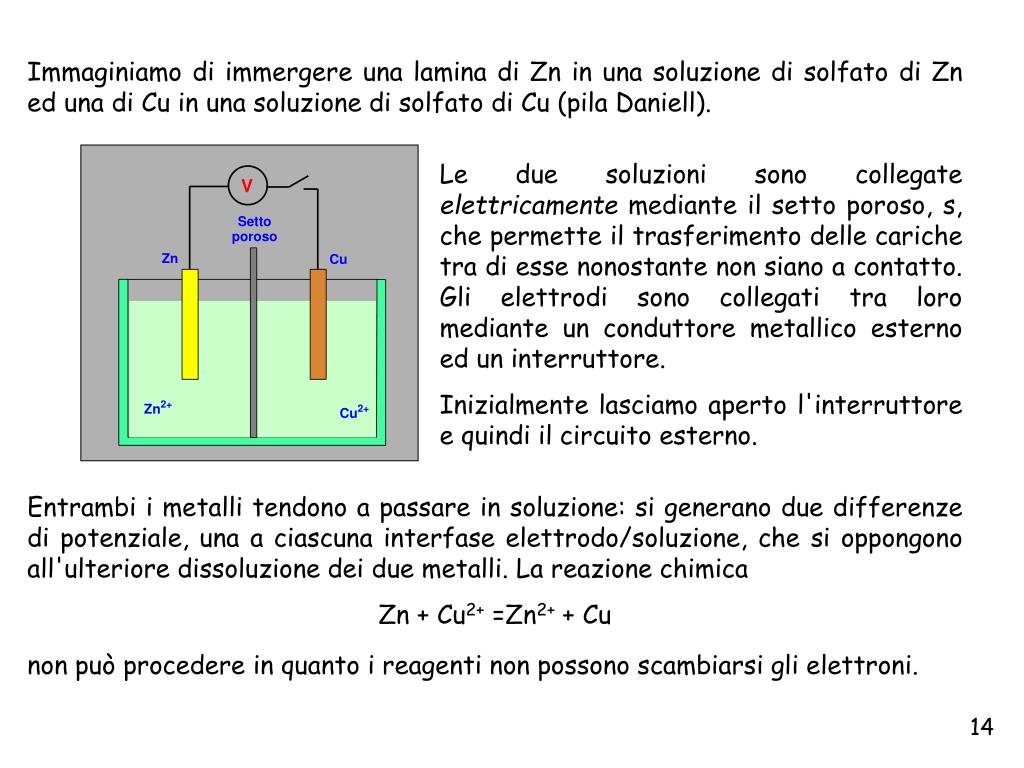
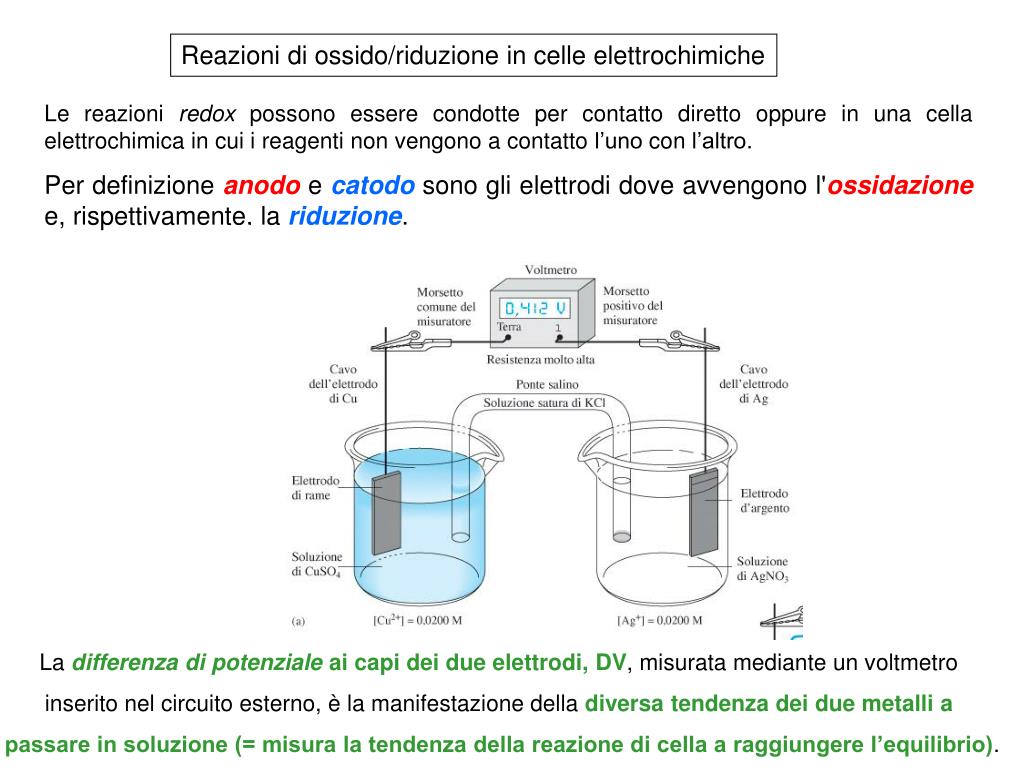
Celle Galvaniche (Voltaiche): Generare Elettricità dalla Chimica
Una cella galvanica, o cella voltaica, è un dispositivo che utilizza una reazione redox spontanea per generare elettricità. È il principio alla base delle batterie che usiamo ogni giorno.
Componenti di una Cella Galvanica
Una cella galvanica tipicamente è costituita da:
- Due semicelle: Ogni semicella contiene un elettrodo immerso in una soluzione elettrolitica.
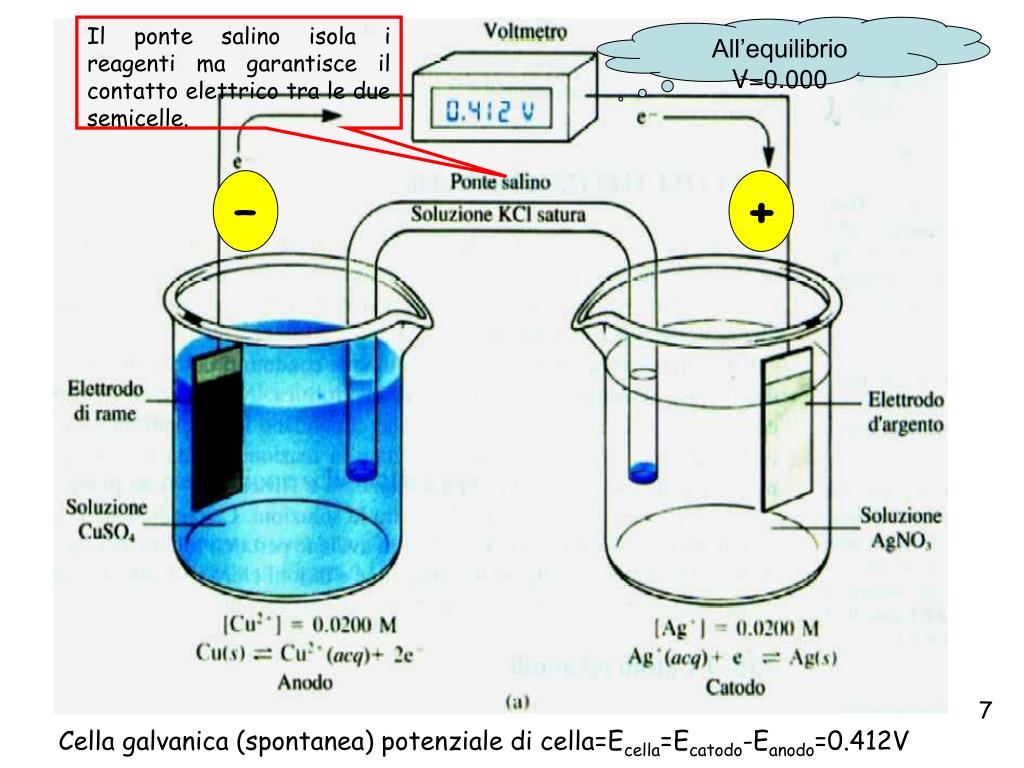
- Elettrodi: Gli elettrodi sono conduttori che permettono il flusso di elettroni. L'elettrodo dove avviene l'ossidazione è chiamato anodo (polo negativo), mentre l'elettrodo dove avviene la riduzione è chiamato catodo (polo positivo).
- Ponte salino: Un ponte salino è un tubo contenente una soluzione elettrolitica che permette il flusso di ioni tra le due semicelle, mantenendo la neutralità elettrica.
- Circuito esterno: Un filo metallico che collega i due elettrodi, permettendo il flusso di elettroni dall'anodo al catodo.
Il Funzionamento di una Cella Galvanica
Nel caso della cella di Daniell (basata sulla reazione tra zinco e rame descritta precedentemente), lo zinco metallico nell'anodo si ossida, rilasciando elettroni che fluiscono attraverso il circuito esterno verso il catodo di rame. Gli ioni zinco (Zn2+) entrano nella soluzione. Al catodo, gli ioni rame (II) (Cu2+) nella soluzione si riducono, depositandosi come rame metallico sull'elettrodo. Il ponte salino permette il flusso di ioni (ad esempio, ioni potassio K+ e ioni cloruro Cl-) per compensare le variazioni di carica nelle due semicelle e mantenere la neutralità.
La differenza di potenziale tra i due elettrodi è chiamata potenziale di cella (E0cella) ed è una misura della forza motrice della reazione redox. Un potenziale di cella positivo indica che la reazione è spontanea.
Elettrolisi: Usare l'Elettricità per Indurre Reazioni Chimiche
L'elettrolisi è il processo inverso della cella galvanica. Invece di generare elettricità da una reazione chimica, l'elettrolisi utilizza l'elettricità per forzare una reazione chimica non spontanea a verificarsi.
Il Processo di Elettrolisi
Per eseguire l'elettrolisi, si immergono due elettrodi in una soluzione elettrolitica (o in un sale fuso) e si applica una corrente elettrica esterna. L'elettrodo collegato al polo positivo della sorgente di corrente è l'anodo (dove avviene l'ossidazione), mentre l'elettrodo collegato al polo negativo è il catodo (dove avviene la riduzione).
Esempi di Elettrolisi
Un esempio comune è l'elettrolisi dell'acqua, in cui l'acqua viene decomposta in idrogeno e ossigeno gassosi applicando una corrente elettrica.
2H2O(l) → 2H2(g) + O2(g)
All'anodo, l'acqua viene ossidata per formare ossigeno gassoso e ioni idrogeno (H+).
2H2O(l) → O2(g) + 4H+(aq) + 4e-
Al catodo, gli ioni idrogeno vengono ridotti per formare idrogeno gassoso.
4H+(aq) + 4e- → 2H2(g)
L'elettrolisi ha molte applicazioni industriali, tra cui:
- Produzione di metalli: Come l'alluminio e il sodio.
- Produzione di cloro e idrogeno: Utilizzati in molti processi chimici.
- Galvanostegia: Rivestimento di un metallo con un altro per proteggerlo dalla corrosione o migliorarne l'aspetto.
Soluzioni Elettrochimiche: La Chiave per Tecnologie Avanzate
La comprensione della struttura atomica e delle reazioni redox ci permette di creare e ottimizzare soluzioni elettrochimiche innovative che alimentano le tecnologie moderne. Alcuni esempi includono:
- Batterie: Dispositivi che immagazzinano energia chimica e la rilasciano come energia elettrica. Le batterie agli ioni di litio, utilizzate in smartphone, computer portatili e auto elettriche, sono un esempio di tecnologia elettrochimica avanzata.
- Celle a combustibile: Dispositivi che convertono l'energia chimica di un combustibile (come l'idrogeno) direttamente in energia elettrica attraverso una reazione redox. Le celle a combustibile sono considerate una tecnologia promettente per il futuro dell'energia pulita.
- Sensori elettrochimici: Dispositivi che rilevano la concentrazione di specifiche sostanze chimiche in un campione misurando il potenziale elettrochimico o la corrente elettrica. Questi sensori sono utilizzati in medicina, ambiente e industria.
- Corrosione: La corrosione è un processo elettrochimico indesiderato che causa il deterioramento dei materiali metallici. La comprensione dei meccanismi di corrosione è fondamentale per sviluppare materiali più resistenti e proteggere le infrastrutture.
Comprendere la scienza dietro l'elettrochimica ci consente di apprezzare meglio le tecnologie che modellano il nostro mondo e di contribuire allo sviluppo di soluzioni più sostenibili per il futuro. Che si tratti di migliorare le prestazioni delle batterie, sviluppare nuove celle a combustibile o proteggere i materiali dalla corrosione, l'elettrochimica gioca un ruolo cruciale nel progresso scientifico e tecnologico.