Da Cosa è Composto Un Atomo
Immagina di poter rimpicciolirti, talmente tanto da poter osservare la materia nel suo intimo. Cosa vedresti? Vedresti gli atomi, i mattoncini fondamentali di tutto ciò che ci circonda, dagli oggetti che tocchiamo all'aria che respiriamo. Ma da cosa sono fatti questi mattoncini così importanti? Scopriamolo insieme!
Cosa vogliamo scoprire?
Questo articolo è pensato per chiunque sia curioso di capire la composizione della materia a livello fondamentale. Non è necessario avere una laurea in fisica! Cercheremo di spiegare i concetti in modo chiaro e semplice, usando un linguaggio accessibile a tutti. Vogliamo dare a tutti gli strumenti per comprendere come è fatto un atomo e l'importanza di queste minuscole particelle.
L'Atomo: Un Sistema Solare in Miniatura?
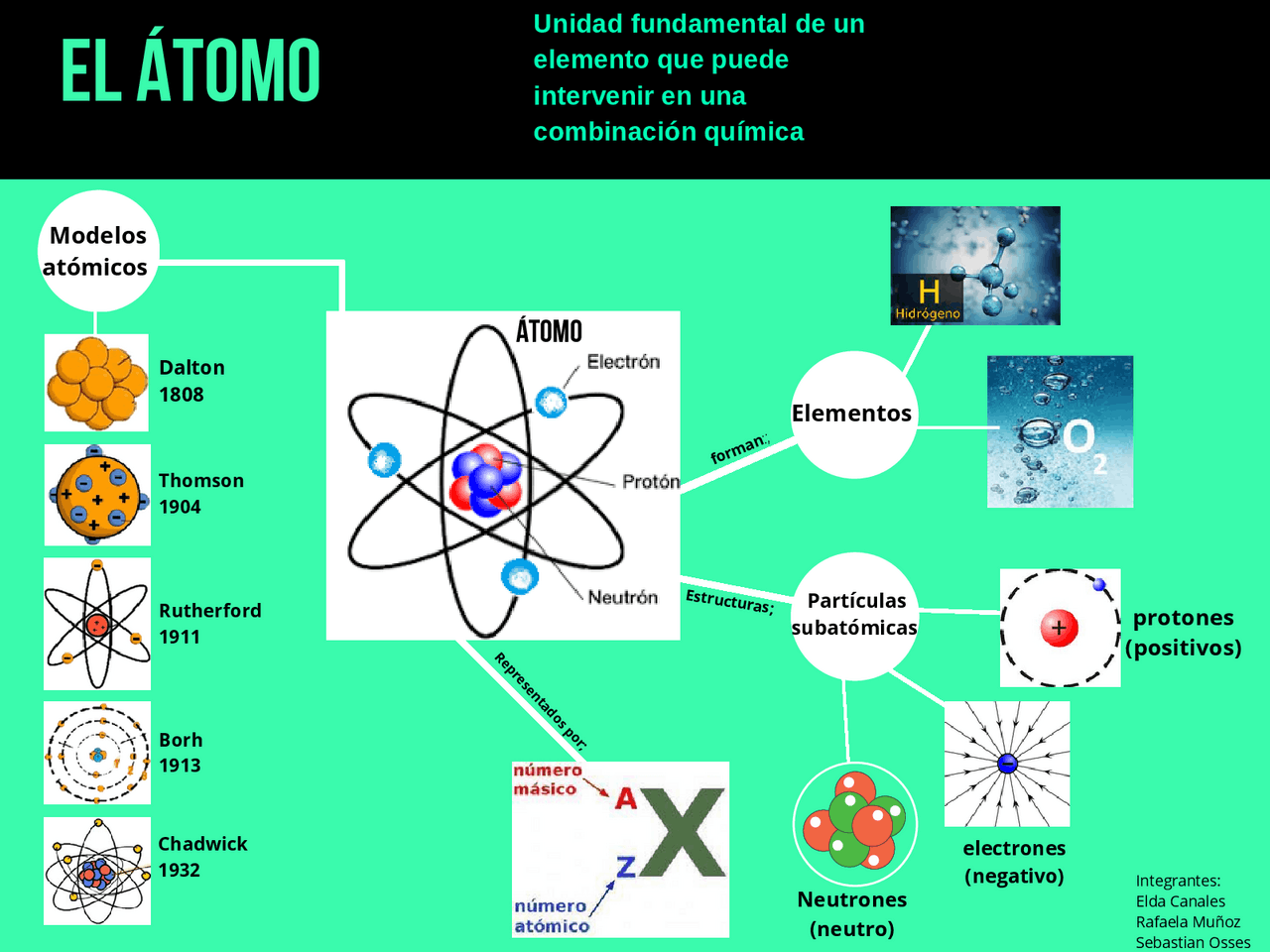
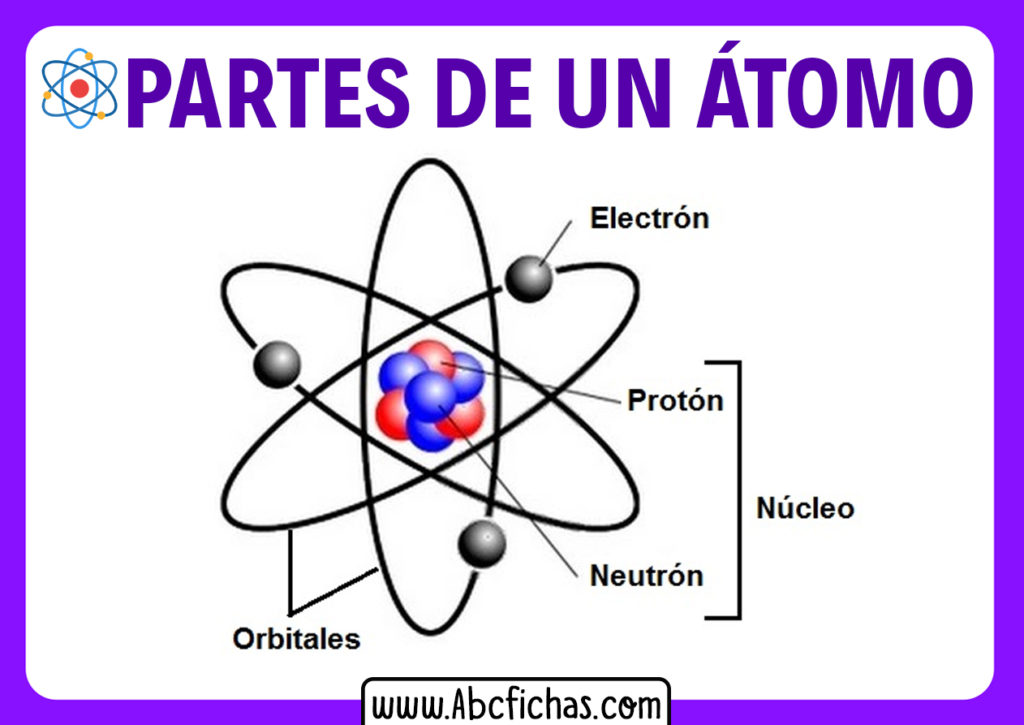
Per molto tempo, l'atomo è stato considerato indivisibile (la parola "atomo" deriva dal greco "atomos", che significa "indivisibile"). Oggi sappiamo che non è così! L'atomo è composto da particelle ancora più piccole, organizzate in una struttura complessa.
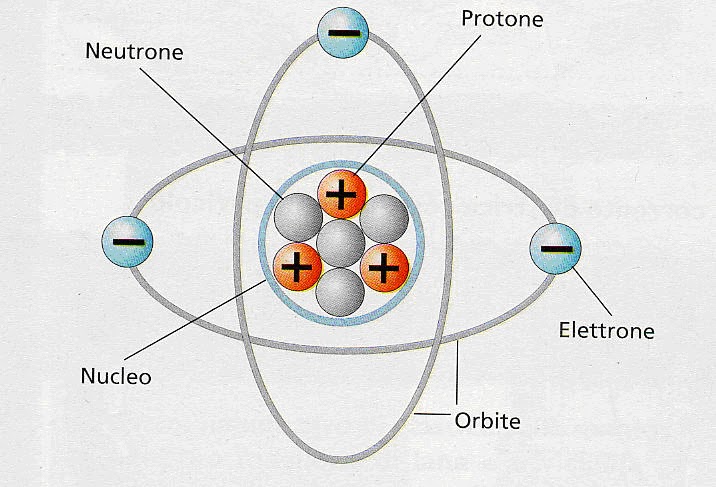
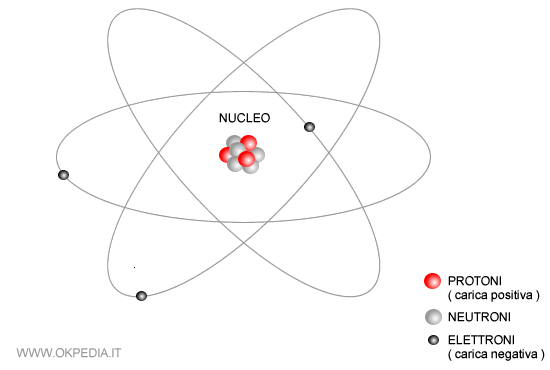
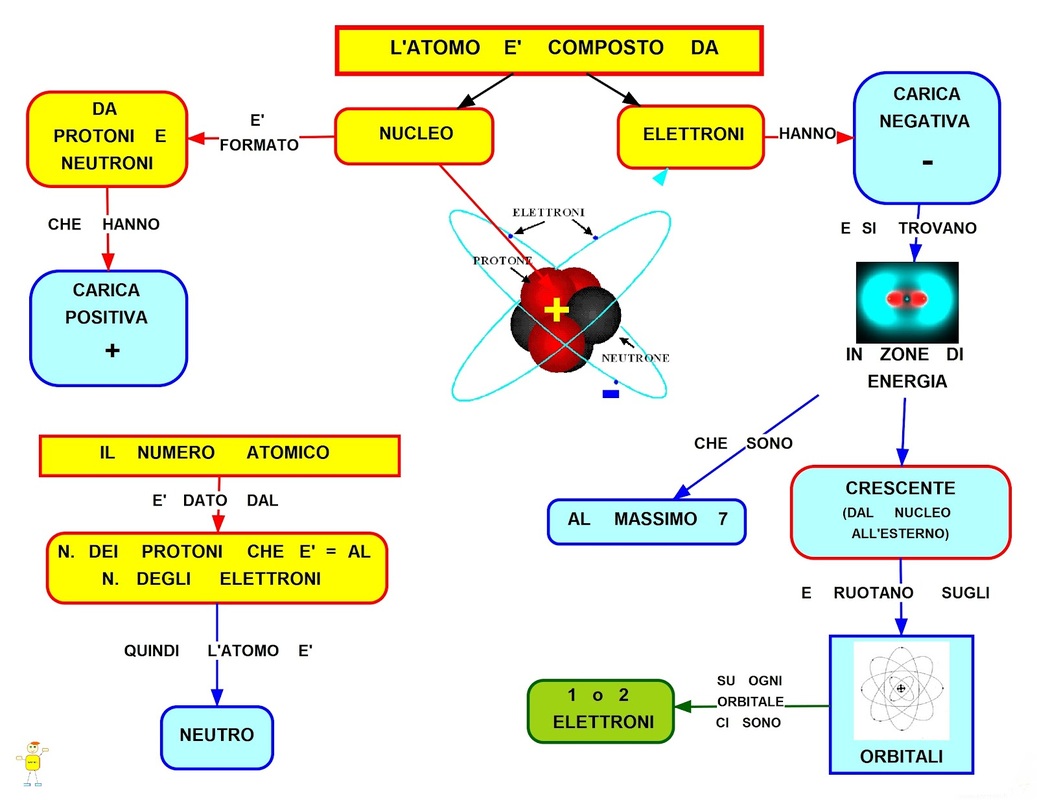
Il Nucleo: Il Cuore dell'Atomo
Al centro dell'atomo troviamo il nucleo, una regione estremamente densa e positiva. Il nucleo contiene due tipi di particelle:
- Protoni: Particelle con carica elettrica positiva. Il numero di protoni determina l'elemento chimico a cui appartiene l'atomo. Ad esempio, tutti gli atomi con un protone sono atomi di idrogeno, mentre quelli con sei protoni sono atomi di carbonio.
- Neutroni: Particelle neutre, cioè senza carica elettrica. I neutroni contribuiscono alla massa del nucleo e aiutano a stabilizzarlo, contrastando la repulsione tra i protoni, che hanno tutti carica positiva.
Il numero di protoni nel nucleo è chiamato numero atomico (solitamente indicato con la lettera Z) ed è una proprietà fondamentale che identifica un elemento. La somma dei protoni e dei neutroni nel nucleo è chiamata numero di massa (solitamente indicata con la lettera A).
Esempio: Un atomo di carbonio ha 6 protoni e, solitamente, 6 neutroni. Il suo numero atomico è 6 e il suo numero di massa è 12 (6 + 6).
Gli Elettroni: I Messaggeri Nascosti
Attorno al nucleo ruotano gli elettroni, particelle con carica elettrica negativa. Gli elettroni sono molto più leggeri dei protoni e dei neutroni. La loro massa è circa 1/1836 di quella del protone. Gli elettroni non orbitano attorno al nucleo in orbite fisse, come i pianeti attorno al sole, ma si muovono in regioni dello spazio chiamate orbitali atomici. La forma e l'energia di questi orbitali sono determinate dalla meccanica quantistica.
Immagina gli orbitali come delle nuvole che circondano il nucleo. La probabilità di trovare un elettrone in una certa regione di questa nuvola è più alta che altrove. Gli elettroni si dispongono in diversi livelli energetici, chiamati gusci elettronici. Il guscio più vicino al nucleo ha l'energia più bassa, mentre i gusci più esterni hanno energie più alte.
- Gli elettroni sono fondamentali per le reazioni chimiche.
- Sono responsabili del legame tra gli atomi per formare molecole.
- Il numero di elettroni di valenza (gli elettroni nel guscio più esterno) determina la reattività chimica di un atomo.
Un Equilibrio Perfetto
In un atomo neutro, il numero di protoni (cariche positive) è uguale al numero di elettroni (cariche negative). Questo significa che la carica totale dell'atomo è zero. Se un atomo guadagna o perde elettroni, diventa uno ione. Uno ione con carica positiva (che ha perso elettroni) è chiamato catione, mentre uno ione con carica negativa (che ha guadagnato elettroni) è chiamato anione.
Isotopi: Variazioni sul Tema
Gli atomi dello stesso elemento chimico (cioè con lo stesso numero di protoni) possono avere un numero diverso di neutroni. Queste varianti sono chiamate isotopi. Gli isotopi hanno le stesse proprietà chimiche, ma masse diverse. Alcuni isotopi sono stabili, mentre altri sono instabili e decadono emettendo radiazioni. Questi sono gli isotopi radioattivi, utilizzati in medicina, nell'industria e nella ricerca scientifica.
Esempio: L'idrogeno ha tre isotopi principali: l'idrogeno-1 (prozio), con un protone e zero neutroni; l'idrogeno-2 (deuterio), con un protone e un neutrone; e l'idrogeno-3 (trizio), con un protone e due neutroni. Il trizio è radioattivo.
La Tavola Periodica: L'Alfabeto della Materia
La tavola periodica degli elementi è un sistema per organizzare tutti gli elementi chimici conosciuti in base al loro numero atomico e alle loro proprietà chimiche. Gli elementi sono disposti in righe (periodi) e colonne (gruppi) in modo da evidenziare le somiglianze tra gli elementi. La tavola periodica è uno strumento fondamentale per i chimici e i fisici perché fornisce informazioni preziose sulle proprietà degli elementi e su come essi interagiscono tra loro.
Ogni elemento nella tavola periodica è identificato da un simbolo chimico (ad esempio, H per l'idrogeno, O per l'ossigeno, C per il carbonio) e dal suo numero atomico.
Perché è importante saperlo?
Comprendere la struttura dell'atomo è fondamentale per una miriade di applicazioni in diversi campi:
- Chimica: Per capire come le sostanze reagiscono tra loro, formando nuove molecole e materiali.
- Fisica: Per studiare le proprietà della materia a livello fondamentale e sviluppare nuove tecnologie.
- Medicina: Per sviluppare nuovi farmaci e tecniche di imaging diagnostico.
- Scienza dei materiali: Per progettare nuovi materiali con proprietà specifiche, come la resistenza, la leggerezza o la conducibilità.
- Energia: Per sviluppare nuove fonti di energia pulita e sostenibile, come l'energia nucleare o l'energia solare.
La nostra comprensione dell'atomo ci ha permesso di sviluppare tecnologie rivoluzionarie, come il laser, il transistor e la risonanza magnetica. La ricerca continua in questo campo promette di portare a nuove scoperte e innovazioni che trasformeranno il nostro mondo.
In conclusione
L'atomo, pur essendo infinitesimamente piccolo, è il mattone fondamentale della materia. Conoscere la sua composizione – protoni, neutroni ed elettroni – ci permette di comprendere il mondo che ci circonda a un livello profondo. Questa conoscenza non è solo teorica, ma ha implicazioni pratiche enormi, influenzando la nostra vita quotidiana in modi che spesso nemmeno immaginiamo.
Speriamo che questo articolo ti abbia fornito una visione chiara e accessibile della struttura dell'atomo. Continua a esplorare, a fare domande e a nutrire la tua curiosità. Il mondo della scienza è pieno di meraviglie che aspettano di essere scoperte!