Cosa Dice La Legge Di Dalton

Ti sei mai chiesto come mai l'aria che respiri, pur essendo un miscuglio di gas, si comporta in modo così "ordinato"? O magari, hai mai riflettuto su come funziona la miscelazione dei gas in una bombola per immersione subacquea? La risposta, in gran parte, risiede in un principio fondamentale della chimica e della fisica: la Legge di Dalton. Se ti senti un po' spaesato di fronte a questa legge, non preoccuparti! Questo articolo è pensato proprio per te: ti spiegheremo in modo chiaro e semplice cosa dice la Legge di Dalton, perché è importante e come si applica nella vita di tutti i giorni.
Cos'è la Legge di Dalton?
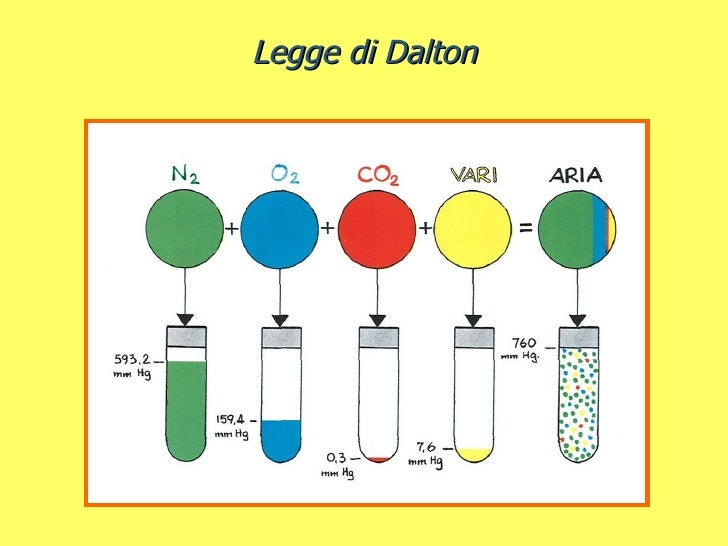
La Legge di Dalton, detta anche Legge delle Pressioni Parziali, afferma che la pressione totale esercitata da una miscela di gas è uguale alla somma delle pressioni parziali di ciascun gas componente. In parole povere, ogni gas presente in una miscela contribuisce alla pressione totale come se fosse da solo ad occupare l'intero volume.
Immagina una stanza piena di persone. Ogni persona esercita una certa pressione sul pavimento. La pressione totale sul pavimento è data dalla somma delle pressioni esercitate da ogni singola persona. La Legge di Dalton è simile: ogni gas in una miscela esercita una pressione, e la pressione totale è la somma di tutte queste pressioni.
Matematicamente, la Legge di Dalton si esprime così:
Ptotale = P1 + P2 + P3 + ... + Pn
Dove:
- Ptotale è la pressione totale della miscela di gas.
- P1, P2, P3, ..., Pn sono le pressioni parziali dei singoli gas nella miscela.
La pressione parziale di un gas è la pressione che quel gas eserciterebbe se occupasse da solo l'intero volume della miscela alla stessa temperatura.
Come Calcolare le Pressioni Parziali
Esistono diversi modi per calcolare le pressioni parziali. Il metodo più comune è utilizzare la frazione molare di ciascun gas nella miscela.
La frazione molare (χ) di un gas è il rapporto tra il numero di moli di quel gas e il numero totale di moli nella miscela:
χi = ni / ntotale
Dove:
- χi è la frazione molare del gas i-esimo.
- ni è il numero di moli del gas i-esimo.
- ntotale è il numero totale di moli nella miscela.
Una volta calcolata la frazione molare, la pressione parziale di un gas si ottiene moltiplicando la frazione molare per la pressione totale:
Pi = χi * Ptotale
Esempio pratico: Immagina di avere una bombola contenente una miscela di azoto (N2) e ossigeno (O2). La pressione totale nella bombola è di 10 atm. Se la frazione molare dell'azoto è 0.8 e quella dell'ossigeno è 0.2, le pressioni parziali saranno:
- PN2 = 0.8 * 10 atm = 8 atm
- PO2 = 0.2 * 10 atm = 2 atm
Quindi, l'azoto esercita una pressione parziale di 8 atm e l'ossigeno una pressione parziale di 2 atm. La somma delle pressioni parziali (8 atm + 2 atm) è uguale alla pressione totale (10 atm), come previsto dalla Legge di Dalton.
Perché è Importante la Legge di Dalton?
La Legge di Dalton non è solo una formula matematica astratta. Ha importanti applicazioni pratiche in diversi campi, tra cui:
Medicina e Fisiologia
La Legge di Dalton è fondamentale per comprendere lo scambio di gas nei polmoni. L'aria che respiriamo è una miscela di gas (principalmente azoto, ossigeno e anidride carbonica). La pressione parziale dell'ossigeno nell'aria inspirata è più alta di quella nel sangue nei polmoni, il che favorisce il passaggio dell'ossigeno dall'aria al sangue. Viceversa, la pressione parziale dell'anidride carbonica nel sangue è più alta di quella nell'aria espirata, il che favorisce il passaggio dell'anidride carbonica dal sangue all'aria.
Questa comprensione è cruciale per il trattamento di diverse condizioni mediche, come l'insufficienza respiratoria o le intossicazioni da monossido di carbonio. Inoltre, permette di calcolare la giusta miscela di gas per i pazienti in terapia intensiva.
Immersione Subacquea
I subacquei respirano aria compressa, e la Legge di Dalton è essenziale per calcolare le pressioni parziali dei gas respirati a diverse profondità. Aumentando la profondità, la pressione totale aumenta, e di conseguenza aumentano anche le pressioni parziali di ciascun gas. Una pressione parziale troppo alta di alcuni gas (come l'azoto o l'ossigeno) può causare problemi di salute, come la narcosi da azoto o la tossicità dell'ossigeno. Conoscere la legge di Dalton permette ai subacquei di pianificare immersioni sicure.
Industria Chimica
La Legge di Dalton è utilizzata per calcolare le quantità di gas necessari per le reazioni chimiche. Ad esempio, nella produzione di ammoniaca, è necessario conoscere le pressioni parziali dell'azoto e dell'idrogeno per ottimizzare il processo e massimizzare la resa.
Meteorologia
Anche in meteorologia la legge di Dalton trova applicazione, in particolare nello studio dell'umidità atmosferica. La pressione parziale del vapore acqueo nell'aria è un fattore determinante per la formazione di nuvole e precipitazioni.
Limitazioni della Legge di Dalton
È importante notare che la Legge di Dalton è una legge approssimativa, valida solo per gas ideali. I gas ideali sono gas in cui le molecole non interagiscono tra loro e occupano un volume trascurabile rispetto al volume totale. In realtà, nessun gas è perfettamente ideale, ma la Legge di Dalton fornisce un'approssimazione sufficientemente accurata per la maggior parte delle applicazioni pratiche.
A pressioni elevate o a basse temperature, le interazioni tra le molecole dei gas diventano più significative, e la Legge di Dalton può non essere più accurata. In questi casi, è necessario utilizzare equazioni più complesse che tengano conto delle interazioni intermolecolari.
Consigli Pratici per Comprendere Meglio la Legge di Dalton
- Esercitati con esempi numerici: Più esercizi fai, più ti familiarizzerai con la formula e con i concetti alla base della Legge di Dalton.
- Visualizza la legge: Immagina una bombola con diversi gas. Pensa a ogni gas che "spinge" sulle pareti della bombola, e alla pressione totale come alla somma di tutte queste spinte.
- Collega la legge ad applicazioni reali: Pensa a come la Legge di Dalton influenza la tua respirazione, le immersioni subacquee o la produzione di sostanze chimiche.
- Non avere paura di chiedere: Se hai dubbi, non esitare a chiedere spiegazioni al tuo insegnante di chimica, a un esperto del settore o a cercare risorse online.
Conclusione
La Legge di Dalton è un principio fondamentale della chimica e della fisica che descrive il comportamento delle miscele di gas. Comprendere questa legge è essenziale per molte applicazioni pratiche, dalla medicina all'immersione subacquea, dall'industria chimica alla meteorologia. Anche se può sembrare complessa all'inizio, con un po' di pratica e di impegno puoi facilmente padroneggiare i concetti e le applicazioni della Legge di Dalton. Speriamo che questo articolo ti abbia fornito una base solida per iniziare il tuo percorso di scoperta!