Come Varia L'elettronegatività Nella Tavola Periodica
Capita a tutti noi, studenti di chimica o appassionati della materia, di trovarci di fronte a concetti apparentemente astratti. Uno di questi è l'elettronegatività. Ma non temere! Cercheremo di rendere questo viaggio nella tavola periodica il più chiaro e interessante possibile. Immagina di dover condividere un panino con un amico. Chi dei due è più "affamato" e cercherà di prendersi la porzione più grande? L'elettronegatività è un po' come la "fame" di un atomo per gli elettroni.
Cos'è l'Elettronegatività?
L'elettronegatività è, in parole semplici, la misura della tendenza di un atomo ad attrarre a sé gli elettroni quando partecipa a un legame chimico. Più un atomo è elettronegativo, più forte sarà la sua "presa" sugli elettroni condivisi.
Per visualizzarlo meglio:
- Pensa a due persone che tirano una corda. Chi tira con più forza (elettronegatività) attirerà la corda (elettroni) verso di sé.
- Un altro esempio è l'ossigeno nell'acqua (H2O). L'ossigeno è molto più elettronegativo dell'idrogeno, quindi attira gli elettroni verso di sé, creando una parziale carica negativa sull'ossigeno e parziali cariche positive sugli idrogeni. Questo rende l'acqua una molecola polare, con conseguenze fondamentali per la vita.
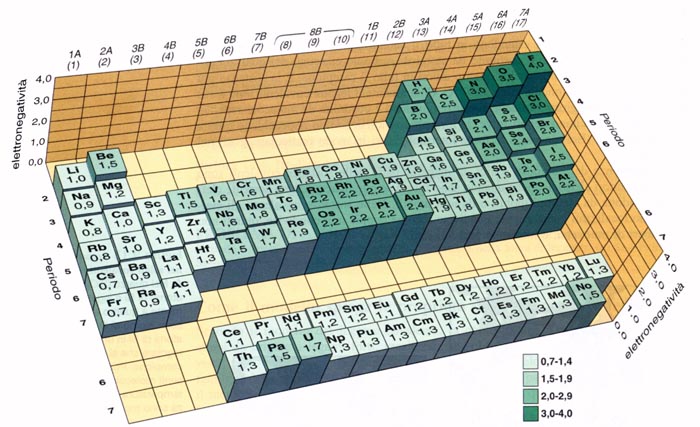
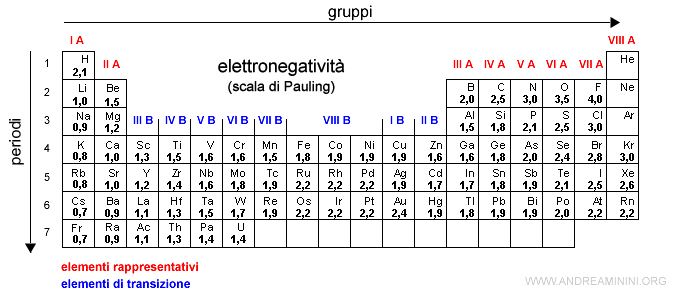
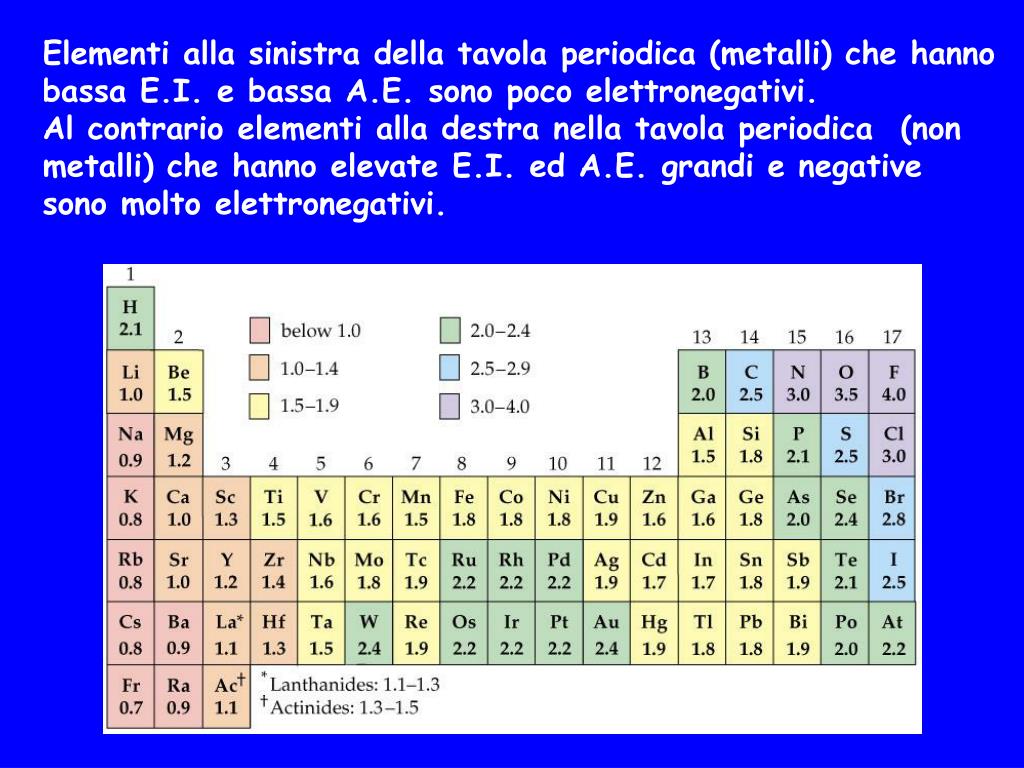
Scale di Elettronegatività
Esistono diverse scale per misurare l'elettronegatività, ma la più usata è la scala di Pauling. Su questa scala, i valori variano tipicamente da 0.7 (per il cesio, l'elemento meno elettronegativo) a 4.0 (per il fluoro, l'elemento più elettronegativo). Ricorda che questi sono solo numeri relativi, che ci permettono di confrontare la tendenza di diversi atomi ad attrarre elettroni.
Come Varia l'Elettronegatività nella Tavola Periodica
Ora arriviamo al punto cruciale: come cambia questa "fame" di elettroni man mano che ci spostiamo nella tavola periodica? La risposta è che ci sono due trend principali:
- Da Sinistra a Destra lungo un Periodo: L'elettronegatività aumenta.
- Dall'Alto al Basso lungo un Gruppo: L'elettronegatività diminuisce.
Cerchiamo di capire perché.
Elettronegatività e Periodi
Quando ci spostiamo da sinistra a destra lungo un periodo, il numero di protoni nel nucleo (la carica nucleare) aumenta. Questo significa che gli elettroni esterni sono attratti con maggiore forza dal nucleo. Allo stesso tempo, gli elettroni vengono aggiunti allo stesso livello energetico (guscio), il che non aumenta significativamente la schermatura dagli elettroni interni. Di conseguenza, l'attrazione del nucleo sugli elettroni di valenza diventa più forte, aumentando l'elettronegatività. In sintesi, più protoni, più attrazione, più elettronegatività.
Immagina che ogni protone sia un piccolo magnete che attira gli elettroni. Più magneti ci sono, più forte sarà l'attrazione.
Elettronegatività e Gruppi
Quando ci spostiamo dall'alto al basso lungo un gruppo, il numero di livelli energetici (gusci) occupati dagli elettroni aumenta. Questo significa che gli elettroni di valenza si trovano sempre più lontani dal nucleo. Inoltre, gli elettroni interni schermano (parzialmente) gli elettroni di valenza dall'attrazione del nucleo. Questo effetto di schermatura riduce l'attrazione efficace del nucleo sugli elettroni esterni, diminuendo l'elettronegatività. In sintesi, più livelli energetici, più schermatura, meno attrazione, meno elettronegatività.
Pensa a un bambino che cerca di raggiungere un giocattolo. Se il giocattolo è vicino, è facile prenderlo. Ma se ci sono molti oggetti (elettroni interni) tra il bambino e il giocattolo, sarà più difficile raggiungerlo.
Eccezioni e Considerazioni Importanti
Come in ogni regola, ci sono delle eccezioni. Ad esempio:
- Gas Nobili: Generalmente, i gas nobili non vengono presi in considerazione quando si parla di elettronegatività, in quanto hanno una configurazione elettronica stabile e una scarsa tendenza a formare legami. Tuttavia, alcuni dei gas nobili più pesanti (come il xeno) possono formare composti e quindi avere valori di elettronegatività misurabili.
- Metalli di Transizione: I metalli di transizione presentano variazioni meno regolari nell'elettronegatività rispetto agli elementi dei gruppi principali. Questo è dovuto alla complessità della loro configurazione elettronica e alla presenza di elettroni negli orbitali d.
Un'altra cosa importante da ricordare è che l'elettronegatività è un concetto relativo. Non è una proprietà intrinseca di un singolo atomo, ma piuttosto una misura della sua tendenza ad attrarre elettroni in un contesto specifico, ovvero quando è legato ad altri atomi.
Perché è Importante l'Elettronegatività?
L'elettronegatività è un concetto fondamentale in chimica perché ci permette di prevedere il tipo di legame che si formerà tra due atomi:
- Legame Covalente: Se la differenza di elettronegatività tra due atomi è piccola, si formerà un legame covalente, in cui gli elettroni sono condivisi (più o meno) equamente. Ad esempio, il legame tra due atomi di idrogeno (H2) è un legame covalente.
- Legame Polare Covalente: Se la differenza di elettronegatività è significativa, si formerà un legame covalente polare, in cui gli elettroni sono condivisi in modo disomogeneo, creando una parziale carica positiva su un atomo e una parziale carica negativa sull'altro. Ad esempio, il legame tra l'ossigeno e l'idrogeno nell'acqua (H2O) è un legame covalente polare.
- Legame Ionico: Se la differenza di elettronegatività è molto grande, si formerà un legame ionico, in cui un atomo (il più elettronegativo) "ruba" completamente gli elettroni all'altro atomo (il meno elettronegativo), formando ioni con carica opposta che si attraggono reciprocamente. Ad esempio, il legame tra il sodio (Na) e il cloro (Cl) nel cloruro di sodio (NaCl, il sale da cucina) è un legame ionico.
Il tipo di legame che si forma influenza le proprietà fisiche e chimiche delle sostanze, come il punto di fusione, il punto di ebollizione, la solubilità e la reattività.
Elettronegatività e Vita di Tutti i Giorni
Forse ti starai chiedendo: "Ma a cosa serve tutto questo nella vita di tutti i giorni?". La risposta è che l'elettronegatività influenza molti aspetti della nostra esistenza, anche se non ce ne rendiamo conto.
- Sapone: I saponi funzionano perché hanno una parte polare (che interagisce con l'acqua, grazie alle differenze di elettronegatività) e una parte non polare (che interagisce con il grasso).
- Cottura: Le reazioni chimiche che avvengono durante la cottura degli alimenti sono influenzate dalle differenze di elettronegatività tra gli atomi coinvolti.
- Farmaci: L'efficacia di molti farmaci dipende dalla loro capacità di interagire con specifiche molecole nel corpo, e queste interazioni sono a loro volta influenzate dalle differenze di elettronegatività.
Controindicazioni e Idee Alternative
Alcuni potrebbero obiettare che l'elettronegatività è un concetto troppo semplificato e che non tiene conto di tutti i fattori che influenzano la formazione dei legami chimici. È vero che ci sono altri fattori importanti, come le dimensioni degli atomi, la polarizzabilità e gli effetti relativistici (soprattutto per gli elementi più pesanti). Tuttavia, l'elettronegatività rimane un utile strumento per comprendere e prevedere il comportamento chimico degli elementi.
Un approccio alternativo consiste nell'utilizzare concetti più avanzati, come la teoria degli orbitali molecolari, per descrivere la formazione dei legami chimici. Tuttavia, questi approcci sono più complessi e richiedono una maggiore conoscenza della chimica quantistica.
Conclusioni e Prossimi Passi
Spero che questo viaggio nell'elettronegatività sia stato illuminante. Abbiamo visto cos'è, come varia nella tavola periodica, perché è importante e come influenza la nostra vita di tutti i giorni. Ricorda che la comprensione di concetti come l'elettronegatività è fondamentale per addentrarsi nel meraviglioso mondo della chimica e per apprezzare la complessità e l'eleganza della materia che ci circonda.
Ora che hai una buona base sull'elettronegatività, ti invito a esplorare ulteriormente questo argomento. Prova a:
- Consultare libri di testo di chimica per approfondire i concetti.
- Cercare online risorse educative, come articoli, video e simulazioni.
- Risolvere esercizi e problemi per mettere alla prova le tue conoscenze.
Quale elemento della tavola periodica ti incuriosisce di più in termini di elettronegatività e perché? Incoraggio la riflessione e la condivisione delle vostre scoperte.