Come Sono Ordinati Gli Elementi Nella Tavola Periodica

Avete mai guardato una tavola periodica degli elementi e vi siete chiesti come mai gli elementi sono disposti proprio in quel modo? Sembra un puzzle complesso, ma in realtà c'è una logica ben precisa dietro l'organizzazione di questo strumento fondamentale della chimica. Questo articolo è pensato per chiunque sia curioso di capire come funziona la tavola periodica, dagli studenti delle scuole medie a chi semplicemente vuole rinfrescare le proprie conoscenze scientifiche. Cercheremo di spiegare in modo chiaro e semplice i principi che governano la disposizione degli elementi, senza usare termini troppo tecnici e rendendo il tutto il più possibile interessante e comprensibile.
La Struttura Fondamentale: Il Numero Atomico
Il principio base che regola l'organizzazione della tavola periodica è il numero atomico. Ma cos'è esattamente? Il numero atomico di un elemento rappresenta il numero di protoni presenti nel nucleo di un atomo di quell'elemento. Ogni elemento ha un numero atomico univoco, che lo identifica in modo inequivocabile. Ad esempio, l'idrogeno ha numero atomico 1 (un protone), l'elio ha numero atomico 2 (due protoni), e così via.
Gli elementi nella tavola periodica sono ordinati in ordine crescente di numero atomico, da sinistra a destra e dall'alto verso il basso. Questo significa che l'elemento con il numero atomico più basso (l'idrogeno) si trova in alto a sinistra, mentre l'elemento con il numero atomico più alto (come l'oganesson) si trova in basso a destra. Potete immaginarla come una scala: ogni gradino rappresenta un protone in più nel nucleo.
Perché i protoni sono così importanti? Perché il numero di protoni determina le proprietà chimiche di un elemento. Gli elementi con lo stesso numero di elettroni di valenza (gli elettroni nel guscio più esterno) tendono a comportarsi in modo simile, e il numero di protoni influenza direttamente la disposizione degli elettroni.
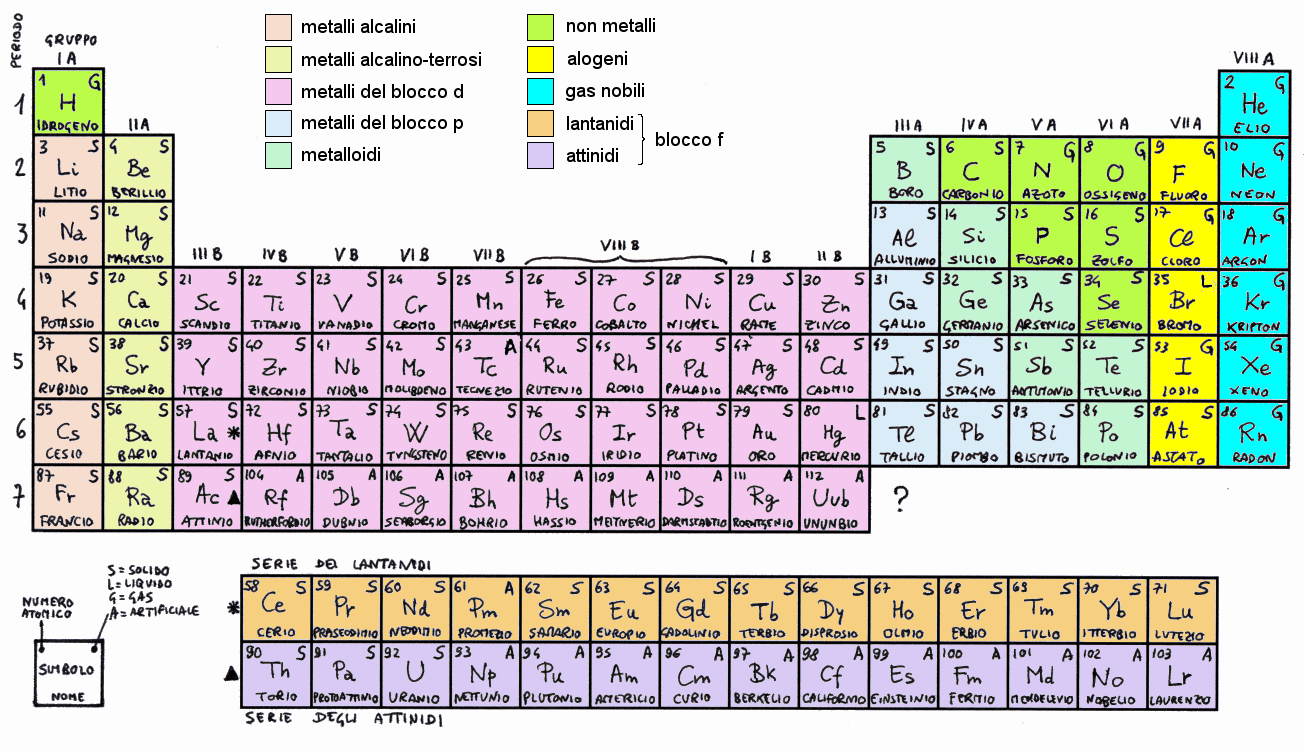
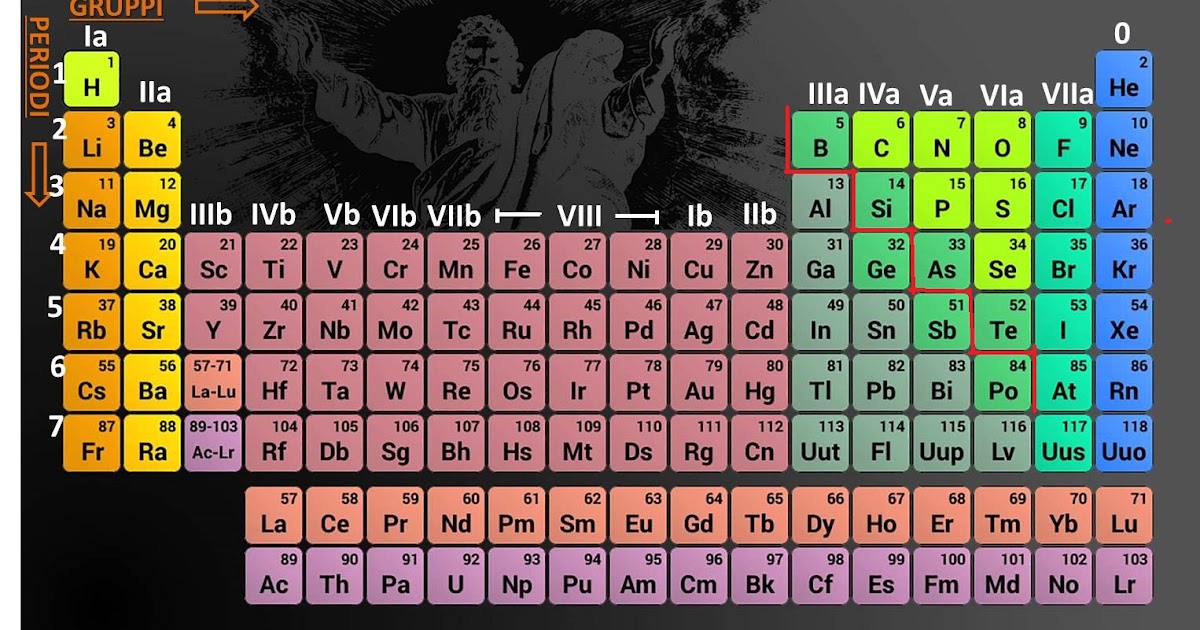
Periodi e Gruppi: Righe e Colonne con un Significato
La tavola periodica non è solo una semplice fila di elementi in ordine di numero atomico. È strutturata in periodi (le righe orizzontali) e gruppi (le colonne verticali). Queste righe e colonne non sono casuali, ma riflettono la configurazione elettronica degli elementi.
I Periodi
I periodi indicano il numero di gusci elettronici occupati da un atomo. Il primo periodo (idrogeno e elio) ha solo un guscio, il secondo periodo (litio al neon) ha due gusci, e così via. Man mano che ci spostiamo lungo un periodo, le proprietà degli elementi cambiano gradualmente. Ad esempio, nel terzo periodo (sodio all'argon), passiamo da un metallo reattivo (sodio) a un gas nobile inerte (argon).
Il numero del periodo corrisponde al numero quantico principale (n) dell'orbitale più esterno occupato dagli elettroni dell'elemento. Questo significa che gli elementi del periodo 3 hanno elettroni nel terzo guscio (n=3).
I Gruppi
I gruppi sono ancora più significativi. Gli elementi nello stesso gruppo hanno la stessa configurazione elettronica nel guscio più esterno, il che significa che hanno proprietà chimiche simili. Questo è perché gli elettroni del guscio più esterno sono quelli che partecipano alle reazioni chimiche.
Ecco alcuni esempi di gruppi importanti:
- Metalli Alcalini (Gruppo 1): Sono metalli molto reattivi che reagiscono violentemente con l'acqua.
- Metalli Alcalino-Terrosi (Gruppo 2): Sono anch'essi reattivi, ma meno dei metalli alcalini.
- Alogeni (Gruppo 17): Sono non metalli molto reattivi che formano facilmente sali.
- Gas Nobili (Gruppo 18): Sono gas inerti, cioè non reagiscono facilmente con altri elementi, perché hanno il guscio esterno completo (8 elettroni, tranne l'elio che ne ha 2).
La somiglianza delle proprietà all'interno di un gruppo è una delle ragioni principali per cui la tavola periodica è così utile. Ci permette di prevedere il comportamento di un elemento conoscendo le proprietà degli altri elementi del suo gruppo.
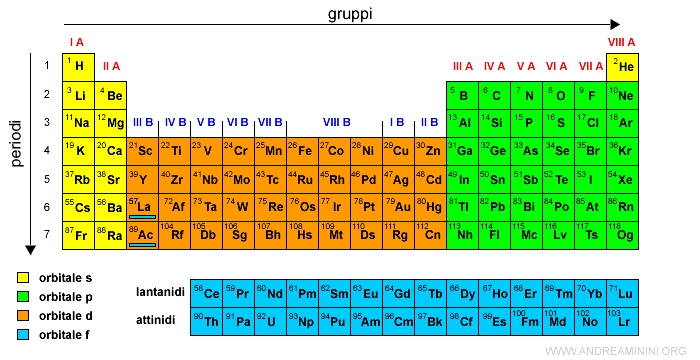
Blocchi: s, p, d, e f
Oltre a periodi e gruppi, la tavola periodica può essere divisa in blocchi, a seconda dell'orbitale atomico che l'ultimo elettrone aggiunto occupa. Questi blocchi sono denominati s, p, d e f.
- Blocco s: Comprende i gruppi 1 e 2 (metalli alcalini e alcalino-terrosi) e l'elio. Gli elettroni più esterni occupano orbitali s.
- Blocco p: Comprende i gruppi da 13 a 18 (boro al neon). Gli elettroni più esterni occupano orbitali p.
- Blocco d: Comprende i gruppi da 3 a 12 (metalli di transizione). Gli elettroni più esterni occupano orbitali d.
- Blocco f: Comprende i lantanidi e gli attinidi (elementi di transizione interna). Gli elettroni più esterni occupano orbitali f. Questi elementi sono solitamente posizionati separatamente sotto il corpo principale della tavola periodica.
La divisione in blocchi riflette direttamente la configurazione elettronica degli elementi e le loro proprietà chimiche.
Tendenze Periodiche: Proprietà che Variano Sistematicamente
La tavola periodica non è solo un elenco di elementi; mostra anche tendenze periodiche, ovvero proprietà degli elementi che variano in modo sistematico lungo i periodi e i gruppi. Comprendere queste tendenze ci aiuta a prevedere il comportamento degli elementi.
- Raggio Atomico: Generalmente diminuisce da sinistra a destra lungo un periodo (perché aumenta la carica nucleare effettiva, che attrae gli elettroni verso il nucleo) e aumenta dall'alto verso il basso lungo un gruppo (perché si aggiungono nuovi gusci elettronici).
- Energia di Ionizzazione: È l'energia necessaria per rimuovere un elettrone da un atomo neutro. Generalmente aumenta da sinistra a destra lungo un periodo (perché è più difficile rimuovere un elettrone da un atomo con una carica nucleare effettiva maggiore) e diminuisce dall'alto verso il basso lungo un gruppo (perché l'elettrone più esterno è più lontano dal nucleo).
- Elettronegatività: È la capacità di un atomo di attrarre elettroni in un legame chimico. Generalmente aumenta da sinistra a destra lungo un periodo (perché gli atomi tendono a completare il loro guscio di valenza) e diminuisce dall'alto verso il basso lungo un gruppo (perché gli elettroni più esterni sono più lontani dal nucleo e quindi meno fortemente attratti).
- Carattere Metallico: Tende a diminuire da sinistra a destra lungo un periodo e aumenta dall'alto verso il basso lungo un gruppo. I metalli tendono a perdere elettroni per formare ioni positivi, mentre i non metalli tendono ad acquisire elettroni per formare ioni negativi.
Queste tendenze non sono sempre perfette, ma forniscono un quadro generale di come le proprietà degli elementi cambiano in base alla loro posizione nella tavola periodica.
Anomalie e Comportamenti Inaspettati
È importante notare che la tavola periodica non è una regola inflessibile. Ci sono eccezioni e anomalie. Ad esempio, alcuni elementi di transizione mostrano configurazioni elettroniche atipiche. Alcune delle tendenze periodiche non sono sempre seguite perfettamente. Queste eccezioni sono dovute alla complessità delle interazioni tra gli elettroni e il nucleo.
Nonostante queste anomalie, la tavola periodica rimane uno strumento incredibilmente potente per comprendere e prevedere il comportamento degli elementi.
La Tavola Periodica nella Vita Quotidiana
La tavola periodica non è solo un oggetto da studiare a scuola. È fondamentale per la chimica, la fisica, la biologia e molte altre discipline scientifiche. È alla base di molte tecnologie che usiamo ogni giorno.
Pensate, ad esempio, ai microchip dei computer, realizzati con il silicio (Si). O alle batterie dei nostri telefoni, che utilizzano litio (Li) e altri metalli. O ai fertilizzanti che usiamo per coltivare il cibo, che contengono azoto (N) e fosforo (P). La tavola periodica ci aiuta a capire come funzionano questi materiali e a svilupparne di nuovi.
Anche in medicina, la tavola periodica ha un ruolo importante. Molti farmaci contengono elementi specifici che interagiscono con il nostro corpo. Ad esempio, il platino (Pt) è utilizzato in alcuni farmaci antitumorali, e lo iodio (I) è essenziale per la funzione della tiroide.
In Conclusione: Un Quadro Organizzato dell'Universo Chimico
La tavola periodica degli elementi è molto più di una semplice tabella. È una rappresentazione visiva della struttura fondamentale della materia. È un sistema che ci permette di organizzare, comprendere e prevedere il comportamento degli elementi che costituiscono il nostro universo.
Speriamo che questo articolo vi abbia aiutato a capire meglio come sono ordinati gli elementi nella tavola periodica e perché questo ordinamento è così importante. Ricordate che la scienza è un processo continuo di scoperta e apprendimento. La tavola periodica è uno strumento che ci aiuta a esplorare il mondo che ci circonda e a svelare i suoi segreti. Quindi, la prossima volta che vedrete una tavola periodica, guardatela con occhi nuovi e apprezzate la sua bellezza e la sua potenza.