Come Si Calcola La Concentrazione Di Una Soluzione

Hai mai preparato un tè o un caffè e ti sei chiesto quanta zucchero aggiungere per ottenere il sapore perfetto? Oppure, in laboratorio, ti sei trovato di fronte a una bottiglia di reagente e hai avuto bisogno di sapere esattamente quanto ce n'è dentro per un esperimento? La risposta a queste domande risiede nel concetto di concentrazione di una soluzione. Questo articolo è pensato per tutti, dagli studenti di chimica alle persone curiose che vogliono capire meglio il mondo che li circonda. Impareremo insieme a calcolare la concentrazione di una soluzione in modo semplice e pratico.
Cos'è la Concentrazione?
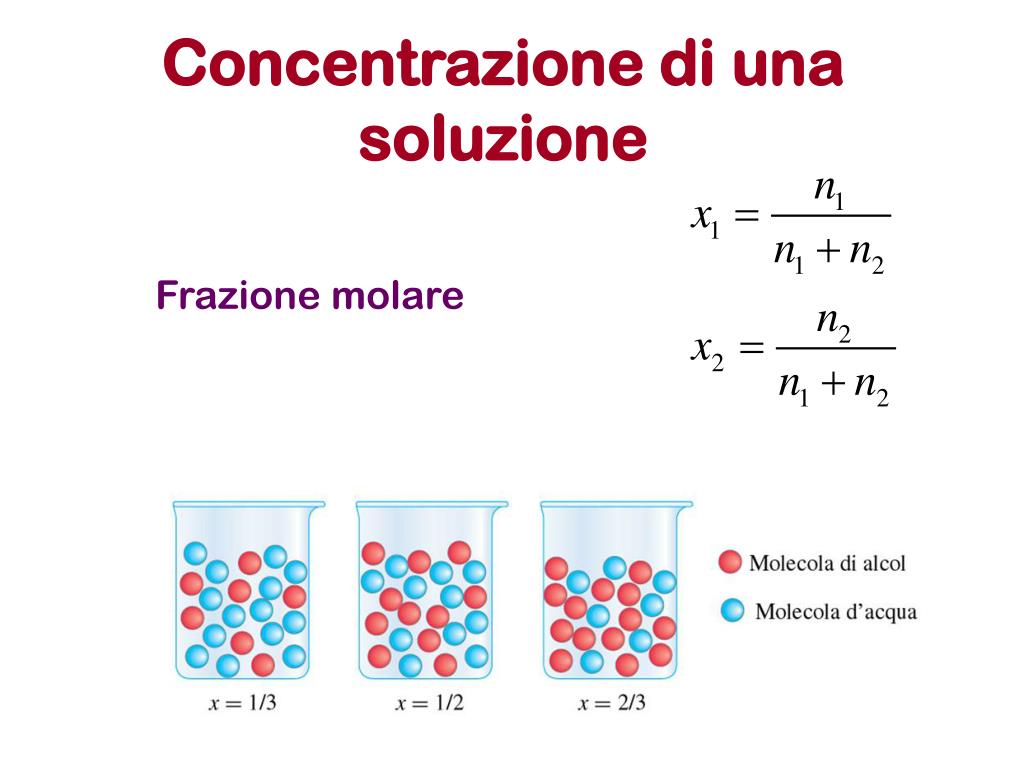
La concentrazione di una soluzione è una misura della quantità di soluto presente in un determinato quantitativo di solvente o di soluzione. In parole povere, ci dice quanto di una certa sostanza è disciolta in un'altra. Immagina di preparare una limonata: il soluto è il succo di limone (la sostanza che si dissolve) e il solvente è l'acqua (la sostanza che dissolve). La concentrazione ci indica quanto "forte" è la limonata, ovvero quanto sapore di limone c'è in ogni bicchiere.
Soluto e Solvente: i Protagonisti della Soluzione
È fondamentale distinguere tra soluto e solvente:
- Soluto: La sostanza che si dissolve in un'altra. Può essere un solido (come lo zucchero), un liquido (come l'alcool) o un gas (come l'anidride carbonica in una bibita).
- Solvente: La sostanza in cui il soluto si dissolve. Di solito è un liquido, come l'acqua, ma può anche essere un solido (come in alcune leghe metalliche).
Diverse Modalità di Esprimere la Concentrazione
Esistono diversi modi per esprimere la concentrazione di una soluzione, ognuno con i suoi vantaggi e svantaggi. Vediamo insieme i più comuni:
1. Molarità (M)
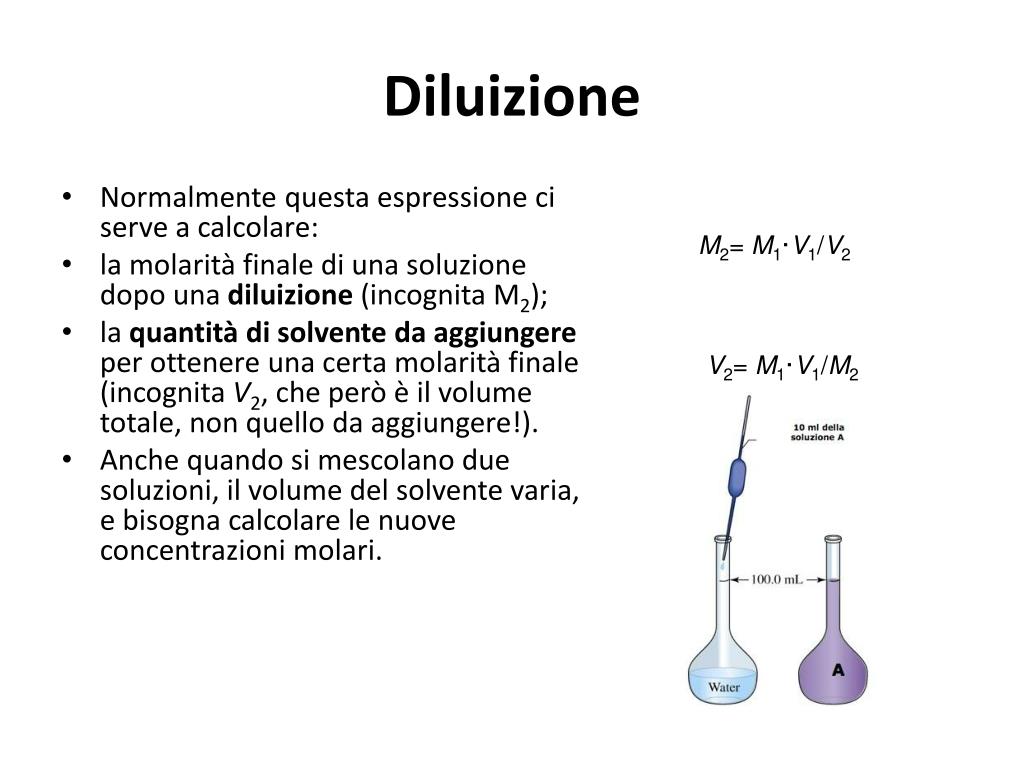
La molarità (M) è definita come il numero di moli di soluto per litro di soluzione. È una delle unità di misura più utilizzate in chimica perché si basa sul concetto di mole, che è direttamente collegato al numero di particelle (atomi, molecole, ioni) presenti. La formula per calcolare la molarità è:
M = moli di soluto / litri di soluzione
Esempio: Se sciogli 1 mole di NaCl (cloruro di sodio, il comune sale da cucina) in acqua e porti il volume totale della soluzione a 1 litro, la molarità della soluzione è 1 M (si legge "uno molare").
2. Molalità (m)
La molalità (m) è definita come il numero di moli di soluto per chilogrammo di solvente. A differenza della molarità, la molalità è indipendente dalla temperatura, poiché si basa sulla massa del solvente e non sul volume della soluzione (che può variare con la temperatura). La formula è:
m = moli di soluto / chilogrammi di solvente
Esempio: Se sciogli 0.5 moli di glucosio in 500 grammi (0.5 kg) di acqua, la molalità della soluzione è 1 m (si legge "uno molale").
3. Percentuale in Massa (% m/m)
La percentuale in massa (% m/m) esprime la massa del soluto come percentuale della massa totale della soluzione. È particolarmente utile quando si lavora con soluzioni solide. La formula è:
% m/m = (massa del soluto / massa della soluzione) x 100
Esempio: Se sciogli 20 grammi di zucchero in 80 grammi di acqua, la massa totale della soluzione è 100 grammi. La percentuale in massa dello zucchero è (20 g / 100 g) x 100 = 20%.
4. Percentuale in Volume (% v/v)
La percentuale in volume (% v/v) esprime il volume del soluto come percentuale del volume totale della soluzione. È comunemente utilizzata per miscele di liquidi. La formula è:
% v/v = (volume del soluto / volume della soluzione) x 100
Esempio: Se misceli 30 mL di alcol etilico con 70 mL di acqua, il volume totale della soluzione è 100 mL. La percentuale in volume dell'alcol è (30 mL / 100 mL) x 100 = 30%.
5. Parti per Milione (ppm) e Parti per Miliardo (ppb)
Le parti per milione (ppm) e le parti per miliardo (ppb) sono utilizzate per esprimere concentrazioni molto basse, come quelle di inquinanti in acqua o aria. Si definiscono come:
- ppm = (massa del soluto / massa della soluzione) x 106
- ppb = (massa del soluto / massa della soluzione) x 109
Esempio: Se trovi 2 mg di mercurio in 1 kg di pesce, la concentrazione di mercurio è 2 ppm (approssimativamente, considerando che la densità del pesce è simile a quella dell'acqua).
Come Calcolare la Concentrazione: Esempi Pratici
Vediamo ora alcuni esempi pratici per capire meglio come applicare le formule che abbiamo visto:
Esempio 1: Calcolo della Molarità
Problema: Sciogli 10 grammi di NaOH (idrossido di sodio) in acqua e porti il volume della soluzione a 250 mL. Calcola la molarità della soluzione.
Soluzione:
- Calcola il numero di moli di NaOH: La massa molare di NaOH è circa 40 g/mol. Quindi, 10 g di NaOH corrispondono a 10 g / 40 g/mol = 0.25 moli.
- Converti il volume in litri: 250 mL = 0.25 L.
- Calcola la molarità: M = 0.25 moli / 0.25 L = 1 M.
Quindi, la molarità della soluzione è 1 M.
Esempio 2: Calcolo della Percentuale in Massa
Problema: Prepara una soluzione sciogliendo 5 grammi di sale in 95 grammi di acqua. Calcola la percentuale in massa del sale.
Soluzione:
- Calcola la massa totale della soluzione: 5 g + 95 g = 100 g.
- Calcola la percentuale in massa: % m/m = (5 g / 100 g) x 100 = 5%.
Quindi, la percentuale in massa del sale nella soluzione è 5%.
Esempio 3: Calcolo della Molalità
Problema: Sciogli 18 grammi di glucosio (C6H12O6) in 200 grammi di acqua. Calcola la molalità della soluzione.
Soluzione:
- Calcola il numero di moli di glucosio: La massa molare del glucosio è circa 180 g/mol. Quindi, 18 g di glucosio corrispondono a 18 g / 180 g/mol = 0.1 moli.
- Converti la massa del solvente in chilogrammi: 200 g = 0.2 kg.
- Calcola la molalità: m = 0.1 moli / 0.2 kg = 0.5 m.
Quindi, la molalità della soluzione è 0.5 m.
Importanza della Concentrazione in Diverse Aree
La concentrazione di una soluzione è un concetto fondamentale in molte discipline, tra cui:
- Chimica: Per calcolare le quantità di reagenti necessarie per una reazione chimica, per studiare le proprietà delle soluzioni e per comprendere i meccanismi di reazione.
- Biologia: Per preparare soluzioni tampone per esperimenti, per determinare la concentrazione di proteine o DNA in un campione e per studiare il trasporto di sostanze attraverso le membrane cellulari.
- Medicina: Per dosare correttamente i farmaci, per analizzare i fluidi corporei (come il sangue o l'urina) e per preparare soluzioni per infusione.
- Scienze ambientali: Per monitorare la qualità dell'acqua e dell'aria, per determinare la concentrazione di inquinanti e per valutare l'impatto delle attività umane sull'ambiente.
- Industria alimentare: Per controllare la qualità dei prodotti alimentari, per preparare soluzioni di conservanti e per dosare correttamente gli ingredienti.
Consigli Pratici per Calcolare la Concentrazione con Successo
Per calcolare la concentrazione di una soluzione in modo corretto, ecco alcuni consigli utili:
- Assicurati di utilizzare le unità di misura corrette: Moli, grammi, litri, chilogrammi. Presta particolare attenzione alle conversioni.
- Utilizza una bilancia precisa: Per pesare con accuratezza il soluto e il solvente.
- Utilizza vetreria volumetrica precisa: Come beute tarate o pipette graduate, per misurare i volumi con precisione.
- Mescola bene la soluzione: Per assicurarti che il soluto si sia completamente dissolto nel solvente e che la soluzione sia omogenea.
- Tieni conto della temperatura: Il volume delle soluzioni può variare con la temperatura, quindi, se è necessario, effettua le misurazioni a temperatura costante.
Conclusione
Comprendere e calcolare la concentrazione di una soluzione è un'abilità essenziale in molti campi. Che tu stia preparando una tazza di tè, conducendo un esperimento in laboratorio o monitorando la qualità dell'acqua, la concentrazione è una misura che ti permette di controllare e comprendere meglio il mondo che ti circonda. Spero che questo articolo ti abbia fornito le basi per calcolare la concentrazione in modo efficace e che tu possa applicare queste conoscenze nella tua vita quotidiana o professionale. Ricorda, la pratica rende perfetti, quindi non aver paura di sperimentare e di mettere alla prova le tue nuove competenze! Buona fortuna!