Chimica Concetti E Modelli Dalla Struttura Atomica All'elettrochimica Soluzioni

La chimica, studio della materia e delle sue proprietà, è una disciplina vasta e complessa che permea ogni aspetto della nostra esistenza. Comprendere i concetti fondamentali che la governano è essenziale per interpretare il mondo che ci circonda e sviluppare nuove tecnologie. Questo articolo si propone di esplorare i concetti e i modelli chimici, partendo dalla struttura atomica e arrivando all'elettrochimica e alle soluzioni, fornendo una panoramica chiara e approfondita.
Dalla Struttura Atomica alla Tavola Periodica
L'Atomo: Il Mattoncino Fondamentale
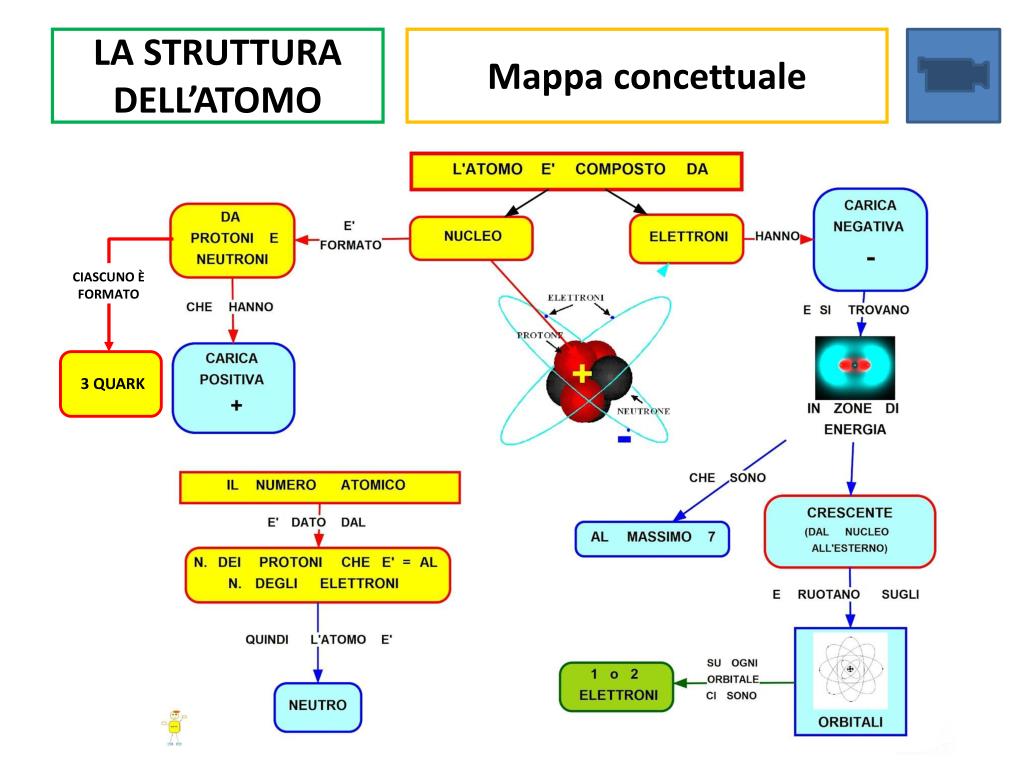
Tutto ciò che vediamo e tocchiamo è composto da atomi, le unità fondamentali della materia. La struttura atomica, con il suo nucleo denso composto da protoni (carica positiva) e neutroni (carica neutra), circondato da elettroni (carica negativa) in movimento, è il punto di partenza per comprendere il comportamento chimico degli elementi. Il numero di protoni, detto numero atomico, definisce l'elemento chimico. Ad esempio, tutti gli atomi con 1 protone sono atomi di idrogeno.
Gli elettroni non si muovono a caso, ma occupano livelli energetici ben definiti, chiamati orbitali atomici. La configurazione elettronica, ovvero la disposizione degli elettroni negli orbitali, determina le proprietà chimiche dell'atomo. Elementi con configurazioni elettroniche simili mostrano comportamenti chimici simili.
Esempio: Il litio (Li) e il sodio (Na) appartengono al gruppo 1 della tavola periodica, i metalli alcalini. Entrambi hanno un solo elettrone nel loro livello energetico più esterno, rendendoli altamente reattivi e predisposti a perdere quell'elettrone per formare ioni positivi (Li+ e Na+).
La Tavola Periodica: Un'Organizzazione Logica
La tavola periodica è un'organizzazione tabellare degli elementi chimici in base al loro numero atomico e alle loro proprietà chimiche. È uno strumento fondamentale per prevedere il comportamento degli elementi e delle loro combinazioni. Gli elementi sono disposti in periodi (righe) e gruppi (colonne). Gli elementi dello stesso gruppo hanno configurazioni elettroniche simili e quindi proprietà chimiche simili.
Esempio: Gli alogeni (gruppo 17) come il fluoro (F) e il cloro (Cl) sono altamente reattivi e tendono a guadagnare un elettrone per formare ioni negativi (F- e Cl-), formando facilmente composti con i metalli.
Legami Chimici: Unire gli Atomi
Legame Ionico: Attrazione Elettrostatica
Il legame ionico si forma quando un atomo cede uno o più elettroni a un altro atomo, creando ioni positivi (cationi) e ioni negativi (anioni). L'attrazione elettrostatica tra questi ioni di carica opposta tiene uniti gli atomi. I composti ionici sono generalmente solidi a temperatura ambiente e hanno alti punti di fusione e di ebollizione.
Esempio: Il cloruro di sodio (NaCl), il comune sale da cucina, è un composto ionico formato dal trasferimento di un elettrone dal sodio al cloro. La forte attrazione elettrostatica tra gli ioni Na+ e Cl- crea un reticolo cristallino stabile.
Legame Covalente: Condivisione di Elettroni
Il legame covalente si forma quando due atomi condividono uno o più elettroni per raggiungere una configurazione elettronica stabile. Questo tipo di legame è comune tra atomi non metallici. A seconda del numero di elettroni condivisi, si possono formare legami singoli, doppi o tripli. La condivisione può essere equa (legame covalente puro) o ineguale (legame covalente polare).
Esempio: La molecola di acqua (H2O) è un esempio di legame covalente polare. L'ossigeno è più elettronegativo dell'idrogeno, il che significa che attrae gli elettroni di legame più fortemente. Questo crea una parziale carica negativa sull'ossigeno e parziali cariche positive sugli idrogeni, rendendo la molecola polare.
Legame Metallico: Un Mare di Elettroni
Il legame metallico si forma tra atomi di metallo. Gli elettroni di valenza sono delocalizzati e formano un "mare" di elettroni che circonda gli ioni metallici positivi. Questa delocalizzazione degli elettroni conferisce ai metalli le loro tipiche proprietà di conducibilità elettrica e termica, duttilità e malleabilità.
Esempio: Il rame (Cu) è un ottimo conduttore di elettricità grazie alla sua struttura metallica e alla presenza di elettroni delocalizzati che possono muoversi facilmente attraverso il reticolo cristallino.
Elettrochimica: Chimica ed Elettricità
Reazioni Redox: Trasferimento di Elettroni
L'elettrochimica studia le reazioni chimiche che coinvolgono il trasferimento di elettroni, chiamate reazioni redox (ossidazione-riduzione). L'ossidazione è la perdita di elettroni, mentre la riduzione è l'acquisto di elettroni. Le reazioni redox sono fondamentali per la produzione di energia elettrica nelle batterie e per molti processi industriali.
Esempio: Nella reazione tra zinco (Zn) e ioni rame (Cu2+), lo zinco si ossida (Zn -> Zn2+ + 2e-) e gli ioni rame si riducono (Cu2+ + 2e- -> Cu). Questa reazione è alla base del funzionamento della pila Daniell.
Celle Galvaniche (Pile): Produzione di Elettricità
Le celle galvaniche, o pile, sono dispositivi che convertono l'energia chimica in energia elettrica attraverso reazioni redox spontanee. Sono composte da due elettrodi immersi in soluzioni elettrolitiche, collegati da un circuito esterno. Il potenziale di cella, o voltaggio, è la differenza di potenziale tra i due elettrodi e determina la forza con cui gli elettroni vengono spinti attraverso il circuito.
Esempio: Le batterie utilizzate negli smartphone sono celle galvaniche che forniscono energia elettrica attraverso reazioni redox controllate. Esistono diversi tipi di batterie, come quelle al litio-ione, al nichel-cadmio e al piombo-acido, ognuna con le proprie caratteristiche e prestazioni.
Elettrolisi: Utilizzo dell'Elettricità per Indurre Reazioni Chimiche
L'elettrolisi è il processo inverso alle celle galvaniche. Utilizza l'energia elettrica per indurre reazioni redox non spontanee. Si applica una corrente elettrica attraverso una soluzione elettrolitica, costringendo gli ioni a reagire agli elettrodi. L'elettrolisi è utilizzata in molti processi industriali, come la produzione di alluminio, cloro e idrogeno.
Esempio: L'elettrolisi dell'acqua (H2O) decompone l'acqua in idrogeno (H2) e ossigeno (O2) gassosi. Questo processo richiede energia elettrica per superare la barriera energetica della reazione.
Soluzioni: Miscele Omogenee
Solvente e Soluto: Componenti di una Soluzione
Una soluzione è una miscela omogenea di due o più sostanze. Il solvente è il componente presente in maggiore quantità e in cui il soluto è disperso. La solubilità di un soluto in un solvente è la quantità massima di soluto che può sciogliersi in una data quantità di solvente a una specifica temperatura.
Esempio: L'acqua salata è una soluzione in cui l'acqua è il solvente e il sale (NaCl) è il soluto.
Concentrazione: Quantificare la Soluzione
La concentrazione di una soluzione esprime la quantità di soluto presente in una data quantità di solvente o di soluzione. Esistono diversi modi per esprimere la concentrazione, tra cui la molarità (moli di soluto per litro di soluzione), la molalità (moli di soluto per chilogrammo di solvente), la percentuale in massa e la frazione molare.
Esempio: Una soluzione 1 M di NaCl contiene 1 mole di NaCl per litro di soluzione. La molarità è una misura di concentrazione ampiamente utilizzata in chimica.
Proprietà Colligative: Dipendenza dal Numero di Particelle
Le proprietà colligative sono proprietà delle soluzioni che dipendono unicamente dal numero di particelle di soluto presenti nella soluzione, e non dalla loro natura chimica. Queste proprietà includono l'abbassamento crioscopico (diminuzione del punto di congelamento), l'innalzamento ebullioscopico (aumento del punto di ebollizione), la pressione osmotica e la tensione di vapore.
Esempio: Aggiungere sale all'acqua fa abbassare il punto di congelamento. Questo è il motivo per cui il sale viene sparso sulle strade ghiacciate in inverno per prevenire la formazione di ghiaccio.
Data: Uno studio sulla pressione osmotica di soluzioni di polimeri ha dimostrato che la pressione osmotica aumenta linearmente con la concentrazione del polimero, confermando la validità delle leggi delle proprietà colligative.
Conclusione
La chimica, dai mattoni fondamentali dell'atomo alle complesse interazioni tra materia ed energia, offre una comprensione profonda del mondo che ci circonda. Comprendere i concetti chiave presentati in questo articolo – struttura atomica, legami chimici, elettrochimica e soluzioni – è fondamentale per affrontare le sfide scientifiche e tecnologiche del futuro. Approfondire ulteriormente questi argomenti, sperimentare in laboratorio e rimanere curiosi è essenziale per chiunque voglia esplorare le meraviglie della chimica.
Call to action: Esplora le risorse online, consulta libri di testo e partecipa a laboratori di chimica per approfondire la tua conoscenza di questi concetti fondamentali. La chimica è ovunque, e comprenderla ti permetterà di vedere il mondo con occhi nuovi!